Introduzione
La monografia “Infiammazione: clinica e terapia” (Parte I e II), pubblicata da “l’Oculista Italiano”, raccoglie numerosi e rilevanti contributi scientifici in cui si mette in evidenza l’importanza della componente flogistica presente in diverse patologie oculari.
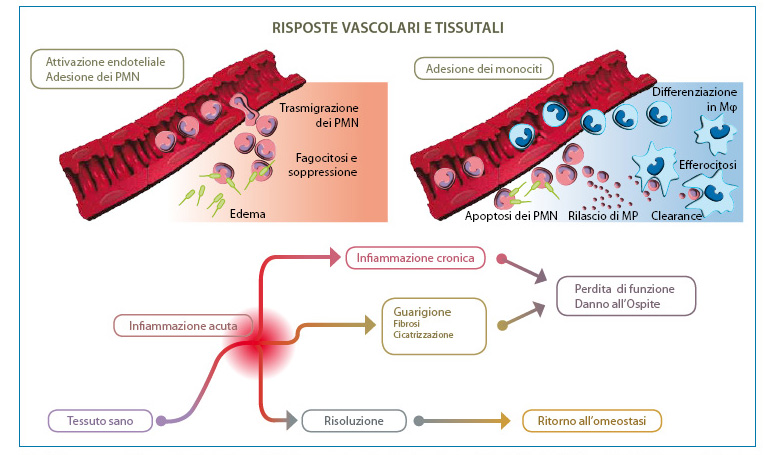
I due volumi descrivono per ciascuna patologia l’attuale trattamento farmacologico, preventivo e/o curativo per la risoluzione terapeutica della flogosi, che coinvolge sia il segmento anteriore che quello posteriore dell’occhio. La risoluzione efficiente della risposta infiammatoria è segnalata dall’esito positivo del trattamento come risulta dall’effetto protettivo dei tessuti compromessi, dalla rimozione dei detriti e delle cellule morte e dal ritorno del tessuto danneggiato all’omeostasi (Fig. 1).
È stato ulteriormente confermato come il processo infiammatorio comporti una complessa cascata di segnali biologici molecolari e cellulari, che alterano le risposte fisiologiche del tessuto oculare interessato.
Dalla monografia emerge, inoltre, chiaramente come la flogosi sia un processo trasversale che, attivato da un evento lesivo, si traduce in particolari sintomi clinici, non solo confinati alle patologie oculari frequentemente associate a processi infiammatori (es. allergia, congiuntivite, cheratite, uveite, ecc.), ma anche, come è stato dimostrato negli ultimi anni, a patologie come il glaucoma, la DMLE e la retinopatia diabetica.
Nuove revisioni emergono dalla monografia da parte di diversi Autori anche sugli aspetti flogistici connessi ad interventi chirurgici oculari e sul ripristino della funzionalità tissutale. Presso il sito della lesione, le cellule rilasciano segnali molecolari che causano una serie di modifiche nella zona interessata: la dilatazione dei vasi sanguigni, l’aumento del flusso sanguigno e della permeabilità vascolare, l’essudazione di liquidi contenenti proteine come le immunoglobuline e l’invasione da parte dei leucociti. Diversi tipi di leucociti, inclusi granulociti, monociti e linfociti, sono coinvolti nel processo infiammatorio.
Il continuo progresso nella conoscenza dei pathway biochimici e cellulari associati alla risposta infiammatoria ha permesso di entrare nei meccanismi più interni delle patologie oculari. Il clinico ha così la possibilità di utilizzare non soltanto farmaci già clinicamente testati e consolidati (corticosteroidi, farmaci anti-infiammatori non-steroidei, agenti antiproliferativi, antisoppressori, biofarmaci), ma di sperimentare anche nuove ipotesi farmacologiche per alcune patologie oculari più complesse grazie alle quali, anche con il supporto di nuove modalità di somministrazione del farmaco, è oggi possibile gestire con sufficiente efficacia molti dei processi infiammatori oculari del segmento anteriore (es. dry eye, cheratite, congiuntivite) ed anche a carico del segmento posteriore dell’occhio (es. edema maculare diabetico, uveite). Tuttavia, pur avendo a disposizione un ampio armamentario terapeutico, per alcune condizioni patologiche oculari, soprattutto quelle contraddistinte da elevata cronicità, l’uso di alcuni farmaci pone problemi di efficacia e/o di tossicità. L’infiammazione cronica e prolungata è una caratteristica determinante per malattie come aterosclerosi, obesità, diabete, artrite reumatoide, asma e diversi tipi di tumore. Molte di queste malattie hanno ormai consolidata manifestazione oculare nella retinopatia diabetica, sclerite, uveite, nella sindrome del dry eye e nelle neoplasie oculari. Questo ci porta ad osservare attentamente anche i progressi farmacologici e clinici che si registrano in aree apparentemente distanti dall’applicazione oftalmica, ma che potenzialmente, per traslazione, potrebbero essere utilizzabili anche in campo oculare. Infatti, nonostante molti tessuti oculari abbiano un sistema immuno-privilegiato o altamente evoluto per proteggere il delicato asse visivo1-3 l’indispensabile controllo dell’infiammazione acuta è regolato dalla stesse vie generali, mediatori e cellule effettrici che gestiscono le risposte infiammatorie in altri organi. Non a caso, la maggior parte degli immunosoppressori utilizzati nelle patologie infiammatorie oculari sono stati originariamente sviluppati nella medicina dei trapianti, per patologie reumatiche o altre malattie sistemiche di origine infiammatoria.
Recentemente, è stata osservata una significativa alterazione nel profilo di citochine e chemochine in campioni di umore acqueo di pazienti diabetici senza alcuna manifesta patologia retinica, ma con una marcata similitudine con quanto riscontrato in pazienti con conclamata retinopatia4. Queste informazioni scientifiche non soltanto conferiscono ulteriore supporto al fatto che l’infiammazione cronica gioca un ruolo significativo nella patogenesi della retinopatia, ma suggeriscono, inoltre, che il processo infiammatorio si attiva prima ancora che la retinopatia (diabetica e/o proliferativa) sia clinicamente diagnosticata. L’alterazione nel profilo di alcune citochine potrebbe, quindi, diventare sia un marker predittivo, ma anche un importante target per lo sviluppo di future opzioni terapeutiche. Inoltre, le considerazioni fin qui descritte rafforzano l’ipotesi che per quanto l’armamentario terapeutico attuale permetta di gestire efficacemente la componente infiammatoria di molte patologie oculari, la richiesta da parte del paziente di nuovi test diagnostici, nuovi farmaci più efficaci e/o più sicuri trova ancora ampi margini sperimentali per essere soddisfatta. Nel proseguo di questo articolo saranno ripresi alcuni accenni sulla farmacologia dell’infiammazione per segnalare alcuni esempi di sviluppo di potenziali nuovi approcci terapeutici che potrebbero, nell’immediato futuro, rivelarsi alternativi e/o complementari rispetto a quelli attualmente in uso.
Sperimentazione farmacologica ed applicazione clinica
Un tratto distintivo della maggior parte delle risposte infiammatorie è il reclutamento di polimorfonucleati (PMN) verso l’endotelio vascolare attivato. Una eccezione è rappresentata dalle risposte autoimmuni o allergiche guidate dai linfociti, sebbene anche i linfociti o i macrofagi avviano risposte infiammatorie (es., asma, artrite reumatoide) caratterizzate da una pronunciata infiltrazione di PMN o eosinofili nel tessuto danneggiato. In effetti, l’eccessiva attivazione o disregolazione dei PMN può causare notevoli danni al tessuto coinvolto nell’infiammazione, come si riscontra in casi di ischemia-riperfusione, fibrosi corneale e cheratite. Ancora più importante, il precoce evento transitorio nella risposta infiammatoria, dovuto all’infiltrazione di PMN, innesca il movimento dei macrofagi verso la rimozione efficiente di PMN non più attivi, un passaggio fondamentale nella risoluzione della infiammazione acuta5 (Fig. 2). Risulta quindi evidente quanto sia indispensabile comprendere i meccanismi di questo processo per la ricerca e lo sviluppo di nuovi agenti terapeutici anti-infiammatori6,7.
[caption id="attachment_1608" align="aligncenter" width="760"]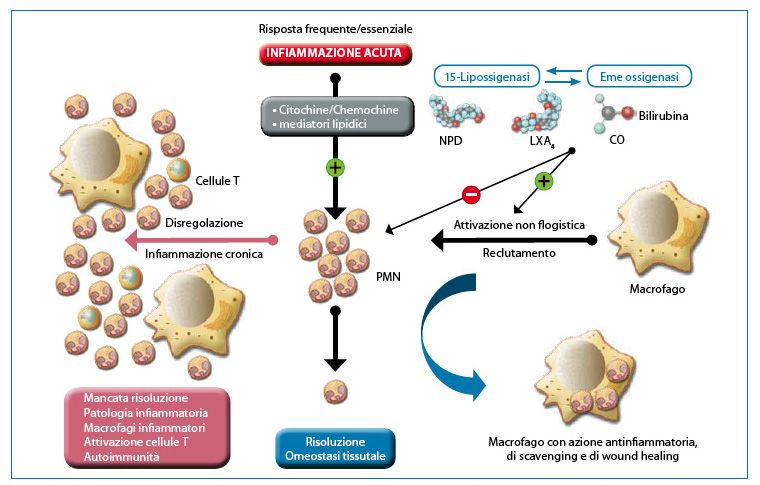 Fig. 2. L’infiammazione utile richiede una risoluzione attiva. I tessuti sperimentano una frequente infiammazione acuta in risposta a lesioni, stress o infezione. Il reclutamento dei PMN nel letto vascolare è avviato e amplificato da circuiti pro-infiammatori ben strutturati ed organizzati. La corretta esecuzione dell’infiammazione acuta necessita di fagocitosi dei PMN da parte dei macrofagi, una risposta non infiammatoria. La fagocitosi dei PMN induce la formazione di mediatori anti-infiammatori per ripristinare la normale funzionalità del tessuto. Circuiti residenti nella cornea, uvea e retina, ossia il 15-LOX e/o HO producono autacoidi che contro-regolano i circuiti pro-infiammatori, riducono l’infiltrazione PMN e attivano i macrofagi per la rimozione di PMN. La disregolazione di questo processo fondamentale pone le basi per lo sviluppo di una malattia infiammatoria. Modificata da: Gronert K. “Resolution, the grail for healthy ocular inflammation”. Exp. Eye Res. 2010; 91(4):478-85.[/caption]
Fig. 2. L’infiammazione utile richiede una risoluzione attiva. I tessuti sperimentano una frequente infiammazione acuta in risposta a lesioni, stress o infezione. Il reclutamento dei PMN nel letto vascolare è avviato e amplificato da circuiti pro-infiammatori ben strutturati ed organizzati. La corretta esecuzione dell’infiammazione acuta necessita di fagocitosi dei PMN da parte dei macrofagi, una risposta non infiammatoria. La fagocitosi dei PMN induce la formazione di mediatori anti-infiammatori per ripristinare la normale funzionalità del tessuto. Circuiti residenti nella cornea, uvea e retina, ossia il 15-LOX e/o HO producono autacoidi che contro-regolano i circuiti pro-infiammatori, riducono l’infiltrazione PMN e attivano i macrofagi per la rimozione di PMN. La disregolazione di questo processo fondamentale pone le basi per lo sviluppo di una malattia infiammatoria. Modificata da: Gronert K. “Resolution, the grail for healthy ocular inflammation”. Exp. Eye Res. 2010; 91(4):478-85.[/caption]
L’infiammazione acuta è un processo dinamico in continua evoluzione ed in quanto tale rappresenta anche uno stato “instabile” che può risolversi o persistere. In generale, l’infiammazione acuta procede verso il suo naturale risultato ideale, che è la risoluzione, con la neutralizzazione degli agenti nocivi, la cessazione dell’infiltrazione di PMN e il ripristino funzionale dei tessuti (Fig. 2). Tradizionalmente, le terapie anti-infiammatorie oculari si sono concentrate su strategie in grado di diminuire o neutralizzare il livello di mediatori pro-infiammatori e/o inibire l’attivazione dei leucociti. Queste terapie comprendono farmaci anti-infiammatori non steroidei (FANS), glucocorticoidi (GC) agonisti dei recettori GC e di anticorpi o inibitori di citochine pro-infiammatorie target-specifici, come nel caso del fattore di necrosi tumorale alfa (TNF)-? e interleuchina (IL)-1. Negli ultimi anni è stato riconosciuto che le strategie terapeutiche basate sulla pro-risoluzione sono potenzialmente efficaci nel trattamento di molteplici condizioni infiammatorie8-11. In realtà, la risoluzione è un processo attivo che coinvolge innumerevoli mediatori e diversi pathway biochimici di controllo e che si esplica mediante:
1) risoluzione della risposta infiammatoria;
2) il passaggio dalla generazione di mediatori pro-infiammatori alla produzione di mediatori pro-risoluzione; 3) spegnimento della trasduzione dei segnali associati alla produzione di citochine e alla sopravvivenza dei leucociti;
4) apoptosi delle cellule infiammatorie attivate;
5) fagocitosi di cellule apoptotiche (soprattutto da parte dei macrofagi in un processo non-flogistico)
6) commutazione da fenotipi cellulari pro-infiammatori a fenotipi di pro-risoluzione (particolarmente rilevante per i macrofagi).
Mediatori lipidici pro-risolventi
Si deve soprattutto a Serhan e ai suoi collaboratori la scoperta di un certo numero di mediatori lipidici, derivati da acidi grassi polinsaturi, quali agenti anti-infiammatori e pro-risolventi dell’infiammazione12-14. Questi includono le lipossine, le risolvine della serie E (RvE) e della serie D (RvD), le protettine/neuroprotettine e le maresine. Risolvine, lipossine, protettine e maresine sono sintetizzate a partire dall’acido arachidonico (AA) e dagli acidi grassi ?-3 eicosapentaenoico (EPA) e docosaesaenoico (DHA) (Fig. 3).
[caption id="attachment_1611" align="aligncenter" width="761"]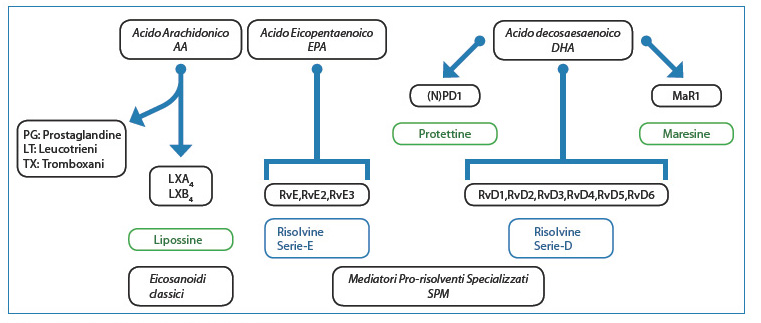 Fig. 3. Biosintesi dei mediatori lipidici prorisolventi.[/caption]
Fig. 3. Biosintesi dei mediatori lipidici prorisolventi.[/caption]
Le biosintesi avvengono come eventi trans-cellulari, i cui dettagli sono stati recentemente esaminati da Serhan15. L’utilizzo della lipidomica ha permesso inoltre al gruppo di Serhan di identificare e caratterizzare le nuove famiglie di mediatori lipidici (Fig. 4).
[caption id="attachment_1610" align="aligncenter" width="750"]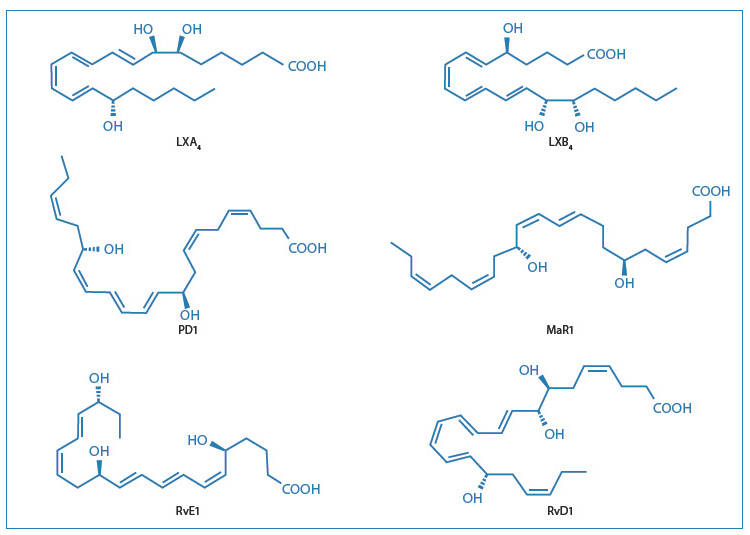 Fig. 4: Strutture dei principali mediatori lipidici pro-risolventi.[/caption]
Fig. 4: Strutture dei principali mediatori lipidici pro-risolventi.[/caption]
I mediatori pro-risolventi sono lipidi bioattivi secreti in risposta ad uno stato infiammatorio e che stimolano eventi molecolari e cellulari fino ad ottenere la risoluzione. I mediatori lipidici sono infatti in grado di promuovere una serie di azioni, come ad esempio il blocco dei leucotrieni e di prostaglandine, con riduzione del rilascio di citochine e del reclutamento dei monociti, oltre a ridurre la rimozione non flogistica di PMN apoptotici, essenziale per l’omeostasi dei tessuti. È stato inoltre dimostrato che i mediatori lipidici hanno un ruolo di modulazione in diversi modelli sperimentali animali di infiammazione acuta e cronica di artrite, peritonite, ischemia-riperfusione, dolore ed asma16-22. Terapie che promuovono attivamente la risoluzione possono anche avere il vantaggio di migliorare le risposte immunitarie innate causate dalle infezioni batteriche21. La possibilità di curare l’infiammazione senza compromettere le difese immunitarie dell’ospite risulta essere la caratteristica più importante conseguibile attraverso la somministrazione di lipossine, risolvine e protettine, o ancora meglio di loro analoghi sintetici stabili, quali agenti terapeutici nella gestione di diverse patologie infiammatorie oculari. Nel loro insieme, quindi, gli studi che saranno menzionati risultano interessanti per le prospettive di sviluppo per nuovi farmaci anti-infiammatori.
In particolare, questo nuovo approccio modifica il tradizionale uso dei farmaci anti-infiammatori passando dall’antagonismo (terapia inibitoria) all’agonismo (terapia pro-risolvente). Il vantaggio dell’uso di farmaci immuno-risolventi è quello di limitare la continua infiltrazione dei neutrofili, controbilanciare i mediatori pro-infiammatori, migliorare il contenimento e la fagocitosi di detriti cellulari e neutrofili apoptotici e promuovere il ripristino dell’omeostasi tissutale.
Lipossine
La lipossina A4 (LXA4), la lipossina B4 (LXB4) e la lipossina attivata da aspirina (ATL) sono stati tra i primi mediatori biosintetizzati dall’acido arachidonico ad essere riconosciuti come mediatori lipidici anti-infiammatori e pro-risolventi23. In particolare LXA4, la lipossina più studiata, si lega con alta affinità al recettore FPR2/ALX24,25, espresso in diversi tipi di cellule, inclusi neutrofili e monociti, e regolatore di alcune importanti funzioni della risposta immunitaria. L’attivazione di FPR2/ALX mediante LXA4 conduce alla riduzione dei leucotrieni, della migrazione leucocitaria, della produzione di chemochine indotta dal fattore di necrosi tumorale (TNF), dell’espressione dei recettori per le chemochine e delle molecole di adesione, della produzione di interleuchina IL–12 attivata da patogeni e della formazione di superossido, migliorando così la fagocitosi non-flogistica delle cellule apoptotiche da parte dei macrofagi26-28. Questi risultati spiegano anche il motivo per cui attualmente il recettore FPR2/ALX sia al centro di un intenso screening farmacologico per la ricerca di nuovi agenti anti-infiammatori.
È stato inoltre dimostrato che il circuito lipidico autacoide attivato dalla 15-LOX ha un ruolo fondamentale nella generazione di lipossina A4 edè presente anche nella cornea, retina ed uvea29-35.
In uno studio recente è stato stabilito in particolare che i sistemi 15-LOX ed eme-ossigenasi (HO) lavorano in concerto per il controllo della risposta infiammatoria nella cornea31. Una prova evidente di questa attività è stata ottenuta utilizzando un modello di topo knockout che, privo di questi enzimi, produce effetti infiammatori amplificati. In questo studio, il ripristino dell’omeostasi corneale è ottenuto con la somministrazione topica oculare di LXA4.
È stato anche riportato che la somministrazione topica di LXA4 all’interno del tessuto corneale promuove la riepitelizzazione ed è pertanto in grado di ridurre i danni del tessuto dopo lesione29.
L’effetto anti-infiammatorio della somministrazione topica di LXA4 su diversi marker pro-infiammatori è stato dimostrato anche in un modello di uveite indotta da endotossine (EIU) nei ratti36. In questa sperimentazione si dimostra per la prima volta che l’applicazione topica di LXA4 stimola significativamente la riduzione del processo infiammatorio nella camera anteriore dell’occhio. Inoltre, nello stesso studio si riporta che il trattamento topico nei ratto con LXA4 (200 ?g/occhio), se paragonato agli animali trattati con il solo veicolo, riduce anche il passaggio di cellule infiammatorie e stravaso proteico nell’umore acqueo indotto da lipopolisaccaridi. La lipossina LXA4 risulta anche più potente del prednisolone nel ridurre l’infiammazione nel modello di EIU, ed efficace ad una dose 20 volte inferiore. Si ritiene che il possibile meccanismo di questo effetto sia da ricondurre alla capacità di LXA4 di bloccare l’attivazione del fattore nucleare NF-kappa B e conseguentemente alla inibizione della produzione di mediatori pro-infiammatori37. Alte recenti attività sperimentali indicano inoltre che LXA4 esercita unaimportante azione anti-fibrotica contribuendo efficacemente a perfezionare la risoluzione verso l’omeostasi del tessuto38,39. C’è da dire però che l’uso terapeutico di LXA4 è fortemente limitato dal rapido metabolismo in vivo e dalla instabilità chimica. Tuttavia, il processo di sintesi di derivati stabili di LXA4 è già attivo40 e si potrebbero presto ottenere molecole dalla preclinica da sperimentare nella ricerca clinica, per nuove interessanti alternative terapeutiche nella regolazione dell’infiammazione in diverse patologie oculari.
Risolvine
In Tabella 1 sono riportate41 alcune tappe significative sullo studio della risoluzione dell’infiammazione e i relativi collegamenti di sviluppo sperimentale dei mediatori lipidici. Le risolvine sono state le prime molecole pro-risolventi ad essere state sperimentate in clinica.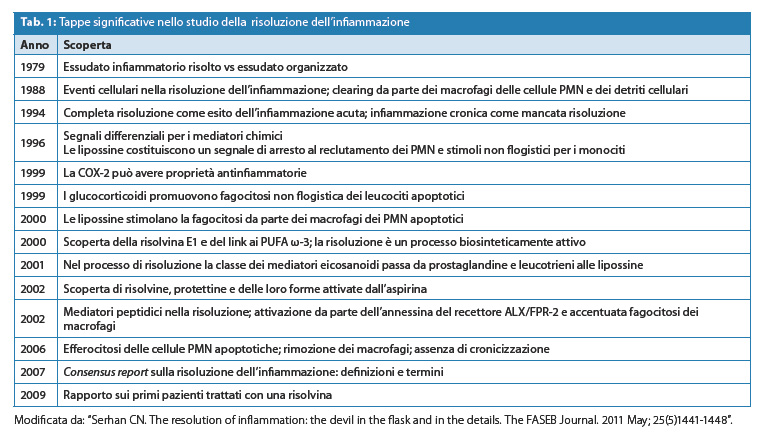
Molte delle attività anti-infiammatorie delle risolvine sono state dimostrate in modelli animali di infiammazione nel trattamento sperimentale di colite, parodontite, danno renale acuto e peritonite. In particolare, le risolvine mostrano attività anti-infiammatoria in quanto riducono l’infiltrazione di neutrofili e l’espressione di citochine pro-infiammatorie. In un modello di infiammazione allergica, RvE1, in quantità di nanogrammi, promuove la risoluzione dell’infiammazione a carico delle vie respiratorie. In parte sopprimendo la produzione di IL-23 e IL-6 ed aumentando inoltre la concentrazioni di interferone-? nei polmoni degli animali trattati42.
In campo oculare le risolvine promuovono la produzione di lacrime, impediscono la perdita di integrità della barriera epiteliale corneale ed inibiscono la trasformazione dei cheratociti a miofibroblasti. Inoltre, queste molecole modulano la risposta cellulare dei linfociti T e riducono l’apoptosi delle cellule goblet congiuntivali43-45. In particolare, negli studi sperimentali condotti sul ratto da Dartt la secrezione delle cellule goblet congiuntivali, componenti importanti nelle patologie del dry eye e dell’allergia oculare, è completamente ridotta dalla risoluzione dell’infiammazione attivata da RvD1 ed RvE1. Questi buoni risultati preliminari hanno incoraggiato ad avviare uno sviluppo oftalmico delle risolvine. Analoghi sintetici della risolvina [RX-10001 (RvE1) ed RX-10045] sono attualmente in fase di valutazione nella terapia del dry eye46. Una prova sperimentale sul ruolo svolto dalla risolvina RvD1 nel regolare la risposta allergica oculare è stata acquisita di recente47. Nello studio si dimostra che l’interazione di RvD1 con il recettore GPR32 attiva48 segnali che bloccano la risposta allergica stimolata da istamina nelle cellule goblet congiuntivali. Questi risultati preliminari positivi aprono interessanti prospettive terapeutiche per le risolvine nel trattamento della congiuntivite allergica oculare o di altre patologie dipendenti dall’istamina.
Come è oramai noto, durante la progressione della neovascolarizzazione coroideale si generano diversi mediatori dell’infiammazione che coinvolgono l’epitelio retinico pigmentato, la membrana di Bruch e altre strutture retiniche. È stato inoltre osservato che cellule retiniche endoteliali in condizioni di flogosi persistente rilasciano risolvine E1 e D1, cui segue la riduzione dell’espressione di molecole pro-infiammatorie e l’inibizione della trasmigrazione di PMN attraverso le barriere delle cellule retiniche coroideali49. È questa una ulteriore conferma del ruolo benefico che potenziali analoghi delle risolvine potrebbero avere come nuovi agenti terapeutici nelle patologie infiammatorie degenerative del segmento posteriore dell’occhio.
Protettine e maresine
Anche le protettine hanno un ruolo chiave nel controllo dei processi infiammatori, come si evince dalla sperimentazione effettuata in modelli animali di peritonite, ischemia/riperfusione, asma e ictus50-53. Gli effetti anti-infiammatori della (neuro)protettina (N)PD1 sono tali da proteggere le cellule epiteliali retiniche dalla apoptosi indotta da stress ossidativo54- 56. Oltre alle proprietà anti-infiammatorie sono state messe in evidenza anche quelle rigenerative di NPD157. Sempre nello stesso studio si ipotizza anche un potenziale ruolo di NPD1 nel trattamento della cornea neurotrofica.
Le maresine, originariamente isolate da essudati di macrofagi murini, mostrano attività anti-infiammatoria con potenza molto simile alla risolvina RvE1 e alla protettina D158,20. Gli effetti anti-infiammatori e pro-risolventi delle maresine sono state confermate in diverse sperimentazioni in vivo condotte con la molecola denominata maresina 1 (MAR1) prodotta da macrofagi umani, la quale inibisce l’infiltrazione dei neutrofili nella peritonite indotta nel topo e migliora l’uptake di neutrofili apoptotici. I dati fin qui acquisiti suggeriscono per le maresine una potenziale applicazione nella modulazione di diversi aspetti del processo infiammatorio e nella risoluzione del dolore e della rigenerazione del tessuto58. Queste ultime caratteristiche mettono le maresine nelle condizioni di essere sperimentate in ambito oftalmico (da sole o in associazione con altri farmaci) in quelle patologie infiammatorie in cui la componente del dolore assume un ruolo preponderante tale da richiedere un adeguato e specifico approccio terapeutico.
Altre opzioni per lo sviluppo di nuovi farmaci ad attività anti-infiammatoria
Nei paragrafi precedenti è stato descritto un esempio di sviluppo farmacologico razionale di nuove classi di molecole potenzialmente utili nella gestione terapeutica dell’infiammazione. Il tempo ci dirà se queste nuove strategie terapeutiche avranno il successo clinico desiderato.
Fortunatamente, la sperimentazione preclinica ha intrapreso diverse strade per la ricerca di nuove ed efficaci soluzioni terapeutiche per contrastare le diverse patologie infiammatorie a carattere sia acuto che cronico.
Antagonisti delle chemochine
Il sistema immunitario è coinvolto direttamente o indirettamente in numerose patologie oculari del segmento anteriore e posteriore dell’occhio: cheratite indotta da virus e da batteri, uveite infettiva e non infettiva (autoimmune), la sindrome del dry eye (occhio secco), gli eventi oncogenici come ad es. il melanoma uveale, il rigetto al trapianto di cornea. Altre patologie includono la degenerazione maculare legata all’età, il glaucoma, le degenerazioni corio-retiniche e la retinopatia autoimmune.
L’infiammazione è centrale nello sviluppo delle risposte immunitarie, sia nelle condizioni normali che in quelle patologiche, ed è oramai dimostrato che il complesso sistema di chemochine non è ben regolato in questo tipo di patologie immuno-dipendenti.
Le chemochine, piccoli peptidi di 8-12 kDa ad azione chemiotattica, sono prodotte da diversi tipi di cellule nei siti dell’infiammazione, intervengono nell’adesione dei leucociti dell’endotelio attivato e nella successiva trasmigrazione e stravaso verso i tessuti infiammati. Tra le famiglie dei recettori per le chemochine CXCR3 è probabilmente quello che gioca un ruolo determinante per lo sviluppo di malattie autoimmuni in quanto produce, in determinati tessuti, cicli di amplificazione locale dell’infiammazione con relativo peggioramento del quadro patologico clinico59. Conseguentemente, CXCR3 è diventato un target molto promettente per il drug discovery che ha portato alla identificazione e sviluppo di diverse molecole antagoniste con potenziale applicazione clinica nel trattamento dell’infiammazione cronica60,61. Una di queste molecole, denominata T487, ha raggiunto lo sviluppo clinico di fase IIa nel trattamento della psoriasi. Sfortunatamente l’assenza di efficacia ne ha fatto sospendere l’ulteriore sperimentazione. Questo risultato negativo, attribuito alla scarsa affinità recettoriale della molecola per il suo target, non ha intaccato la possibilità di continuare a testare questa intereressante strategia terapeutica62. ?
Lo studio sperimentale sul ruolo delle chemochine e dei loro recettori nella patogenesi di patologie oculari causate da infiammazione acuta e cronica è piuttosto nuovo.
Recentemente, l’espressione di alcune chemochine tra cui CXCR3 è stata determinata sia nel film lacrimale che sulla superficie oculare di pazienti con dry eye e soprattutto con sindrome di Sjögren63. Di recente64, inoltre, è stato dimostrato che la superficie oculare di topi privi di recettori per le chemochine è meno soggetta a subire i danni provocati dall’infiammazione per la incapacità delle cellule CD4+T (i linfociti T Helper, la cui funzione principale è quella di organizzare la risposta immunitaria) di dirigersi verso questo tessuto in risposta allo stress di essiccazione. In questo modo si impedisce l’attivazione del loop di amplificazione che porta all’infiammazione cronica e conseguente aggravamento della patologia oculare. Queste osservazioni preliminari fanno prevedere un uso terapeutico di chemochine antagonisti anche nella gestione dell’infiammazione nella patologia del dry eye.
Recentemente un antagonista altamente selettivo per i recettori delle chemochine CCR5 e CXCR3, il prodotto denominato TAK-779, è stato utilizzato con successo nei trapianti di cornea65,66. In questo studio il prodotto è stato iniettato direttamente nello stroma della cornea.
Sennlaub et al. (2013) hanno ipotizzato67, per la prima volta, che in topi knockout, privi del recettore CXCR1, la chemochina CCL2, nota anche come proteina chemiotattica dei monociti 1 (MCP-1), aumenta in occhi con atrofia geografica. Inoltre, è stato osservato che i monociti CCR2+ sono in particolare reclutati nella lesione atrofica. L’accumulo di CCL2 e di CCR2+ è molto più pronunciato nei topi privi di recettore CXCR1, i quali sviluppano infiammazione subretinica e degenerazione fotorecettoriale. L’inibizione di CCL2/CCR2+ potrebbe, quindi, rappresentare un ulteriore target terapeutico per il controllo dell’infiammazione cronica in patologie subretiniche come la DMLE sia nella sua forma atrofica che neovascolare.
Inibitori della fosfodiesterasi 4
Gli inibitori della fosfodiesterasi 4 (PDE4) ed altri agenti terapeutici in grado di far aumentare i livelli di adenosina monofosfato ciclico (cAMP) giocano un ruolo molto importante nel sistema immunitario68. In generale si tratta di molecole che stimolano effetti soppressivi sulle azioni deleterie esercitate dalle cellule infiammatorie69. Negli ultimi anni c’è stata una serie di prove sperimentali in cui è stato dimostrato che cAMP è anche coinvolto nella risoluzione dell’infiammazione70-73. In questi studi è stato riportato che cAMP stimola il passaggio dei macrofagi pro-infiammatori in macrofagi risolventi l’infiammazione. Inoltre, in modelli sperimentali di infiammazione mediata da neutrofili ed eosinofili è stato osservato che l’aumento di cAMP stimolato dalla somministrazione di Rolipram, un inibitore selettivo di fosfodiesterasi, o di altri farmaci cAMP mimetici, ha come risultato conclusivo la risoluzione dell’infiammazione. Recentemente, questa potenziale strategia terapeutica, nel contrastare l’infiammazione mediante specifici agenti in grado di stimolare cAMP, è stata presentata al congresso ARVO 2013. In questo studio74, attraverso studi di farmacocinetica e di studi preclinici in vitro ed in vivo, si dimostra che una formulazione acquosa contenente un inibitore di PDE4, somministrata topicamente nell’occhio del coniglio, è in grado di raggiungere concentrazioni sufficientemente adeguate di farmaco nella cornea, congiuntiva e ghiandola lacrimale. Questo studio preliminare lascia presumere che gli inibitori di fosfodiesterasi-4 possono essere ulteriormente esplorati, come potenziali farmaci, nel trattamento dell’infiammazione della superficie oculare.
Le terapie cellulari nel trattamento dell’infiammazione oculare
Una strada radicalmente diversa dall’approccio farmacologico, descritto in precedenza, nella cura delle patologie infiammatorie oculari potrebbe in futuro arrivare dalla terapia cellulare.
Negli ultimi anni c’è stato un crescente interesse sulla possibile applicazione di terapia cellulare in alcune patologie oculari che incidono maggiormente sul rischio di disabilità visiva. Naturalmente in questo specifico trattamento terapeutico, essendo l’occhio considerato un organo immuno-privilegiato, si assume che ci sia un ridotto rischio di rigetto da parte del sistema immunitario. In una recente review75 vengono messe in evidenza quelle terapie cellulari che potrebbero avere una elevata probabilità di essere impiegate soprattutto nel campo dell’infiammazione intraoculare.
La terapia cellulare si può dividere in due ampie classi: una, attraverso l’impiego di cellule staminali, è finalizzata al rimodellamento della struttura e relativa funzionalità di specifici tessuti e cellule; l’altra, utilizzando cellule immunitarie nel ruolo di potenziali immunomodulatori dell’infiammazione, è diretta verso il ripristino dell’omeostasi immunologica attraverso il controllo di quegli effetti nocivi provocati dalle patologie infiammatorie e che sono stati ampiamente descritti da diversi Autori nei due volumi monografici “Infiammazione: clinica e terapia”, pubblicati da “l’Oculista Italiano”.
Uno dei principali campi della ricerca con cellule staminali è finalizzato al ripristino della visione in pazienti con patologie degenerative retiniche. L’impianto di cellule staminali in questo tipo di patologie è arrivato ad uno stadio di sviluppo molto avanzato76. Un altro settore oftalmico in cui la tecnologia e l’uso clinico delle cellule staminali è notevolmente progredito è l’applicazione di cellule staminali del limbus corneale nelle patologie della superficie oculare. L’occhio presenta una barriera all’invasione microbica ad integrità della superficie oculare in cui il limbus rappresenta la regione di collegamento tra la congiuntiva e l’epitelio corneale, che hanno caratteristiche distinte77. In particolare, l’epitelio corneale ha un capacità rigenerativa estremamente efficiente sia nel normale ricambio omeostatico delle cellule superficiali sia nella risposta alle eventuali lesioni.
Cellule staminali mesenchimali
L’utilizzo di cellule staminali mesenchimali (MSC – Mesenchymal Stem Cell) è stato proposto in diverse patologie autoimmuni e tra queste anche nell’uveite. In un modello sperimentale preclinico di uveite eseguito nel ratto è stato dimostrato che le cellule staminali mesenchimali hanno un effetto terapeutico78. L’uso di MSC è stato esplorato anche in patologie della superficie oculare. In questi studi79,80 le cellule sono somministrate per via intraperitoneale o endovena. Inoltre, poiché non si verifica un loro reale attecchimento nella cornea, si ritiene che le cellule agiscano attraverso la secrezione di una proteina ad attività anti-infiammatoria denominata TSG-6. Quelli appena descritti sono soltanto alcuni esempi presenti in letteratura in cui l’uso di cellule staminali mesenchimali è esteso alla terapia oculare. Risulta altresì evidente come la componente infiammatoria rimanga ancora in primo piano come principale target terapeutico in questo tipo di trattamento cellulare.
Altrettanto interessante è il potenziale uso della terapia cellulare, indirizzata verso quelle cellule infiammatorie che danneggiano il tessuto ospite.
È stato di recente dimostrato che durante la fase di risoluzione dell’infiammazione, cellule accessorie, come le cellule soppressorie di derivazione mieloide (MDSC) e le cellule T regolatorie (Treg) risultano importanti non solo come fattori della risoluzione, ma anche per la loro capacità di mettere in collegamento il sistema immunitario innato con quello adattativo81.
Cellule soppressorie di derivazione mieloide
I macrofagi pro-infiammatori sono importanti mediatori dei danni causati nelle infiammazioni intraoculari82-84 e sono le principali cellule ad essere bloccate dalla terapia anti-TNFa85-87. Tuttavia, come in tutti i processi infiammatori, sottoinsiemi di macrofagi si attivano durante l’evoluzione della malattia, come è stato osservato in un modello di uveoretinite autoimmune (EAU) sperimentale, indotta in topi C57/BL6. In questo modello si dimostra, inoltre, il ruolo chiave delle cellule soppressorie di derivazione mieloide nella risoluzione della patologia infiammatoria. In queste condizioni sperimentali è altresì elevata la possibilità concreta di una significativa cronicità e conseguente neovascolarizzazione retinica e sottoretinica. In considerazione dell’attività anti-infiammatoria mostrata dalle MDSC in diversi tipi di malattia autoimmune88,89, l’uso delle MDSC è stato proposto anche nelle infiammazioni croniche intraoculari, considerato che proprio in queste circostanze le MDSC si espandono ed acquisiscono attività anti-infiammatoria attraverso il rilascio di citochine soppressorie90. È stato così dimostrato che le MDSC indotte da cellule dell’epitelio pigmentato retinico bloccano efficacemente la proliferazione delle cellule T e la produzione di citochine infiammatorie. Inoltre, la somministrazione sistemica di queste cellule inibisce le risposte delle cellule T autoreattive responsabili della lesione retinica nel modello di EAU91. In questo modello cellule T specifiche della retina causano infiammazione locale con il risultato di una rottura della barriera emato-retinica, infiltrazione di leucociti ed infine distacco della retina92.
Una delle principali difficoltà nell’applicazione di MDSC nel controllo di patologie infiammatorie intraoculari consiste essenzialmente nella insufficiente disponibilità di cellule autologhe. È per questo motivo che la ricerca si è decisamente concentrata nel trovare una soluzione valida per superare questo punto critico. È di poco tempo fa la pubblicazione di uno studio in cui è stato dimostrato che colture di precursori monocitari, isolati da sangue periferico in presenza di prostaglandina E2, producono, in modo semplice e clinicamente accettabile, un numero elevato di MDSC93. È stato inoltre osservato che le MDSC possono essere ottenute in grande quantità utilizzando citochine a partire da cellule progenitrici monocitarie. Questi recenti successi ottenuti attraverso lo sviluppo di nuovi metodi per generare MDSC offrono buone opportunità per sperimentare clinicamente in un prossimo futuro l’efficacia delle cellule soppressorie di derivazione mieloide in particolari patologie infiammatorie intraoculari.
– Cellule T regolatorie
Le cellule T regolatorie (Treg), una sottopopolazione di linfociti T CD4+ CD25+ che co-esprimono il fattore di trascrizione Foxp394, regolano le risposte immunitarie attraverso la secrezione di citochine immunosoppressive e pro-risolventi (IL10 e TGF-?), rendendosi così indispensabili nel ripristinare l’omeostasi immunitaria95,96. Proprio in virtù di questa loro caratteristica la prospettiva di utilizzare queste cellule nella terapia di alcune patologie infiammatorie è uno sviluppo ritenuto alquanto logico ed interessante. Ad oggi, il ruolo vantaggioso dell’uso delle Treg è già emerso in una serie di trattamenti di malattie infiammatorie come l’artrite reumatoide97, la sclerosi multipla98 e l’aterosclerosi99.
Sono stati di recente avviati tre studi clinici di fase I per valutare l’assenza di tossicità delle Treg come terapia cellulare nella malattia del trapianto contro l’ospite (GvHD) con risultati soddisfacenti100,101,102. Le Treg somministrate nei bambini con diabete di tipo I sono state in grado di rallentare la progressione della malattia senza causare gravi eventi avversi103.
In assenza di una evidente tossicità delle Treg ed in considerazione del fatto che pazienti con uveite attiva hanno un ridotto livello di Treg circolanti104-106, è stata proposta l’applicazione clinica delle Treg anche nella terapia dell’uveite. A supporto di tale scelta ci sono anche una serie di trattamenti sperimentali in vivo in cui si dimostra che attraverso l’utilizzo di cellule Treg è possibile ottenere una buona efficacia nel controllo dell’infiammazione intraoculare107,108. Una difficoltà incontrata nel tradurre nella pratica clinica la terapia con le Treg è stata principalmente collegata alla elevata frequenza di cellule T convenzionali attivate presenti nella frazione CD4+CD25+ e dalla limitata disponibilità di procedure standard di Buona Pratica di Fabbricazione (BPF) per la rimozione di contaminanti cellulari109. Un altro limite per la loro applicazione clinica è stato associato al ridotto numero di Treg disponibili nella fase di trasferimento110,102. Diversi sono stati gli approcci per una espansione selettiva di cellule Treg umane111-114. Tuttavia, solo di recente115 è stata riportata una robusta procedura per la produzione di Treg per uso clinico. Quest’ultimi risultati sembrano molto promettenti e potrebbero avviare in un prossimo futuro la terapia cellulare con Treg per la modulazione efficace della infiammazione intraoculare cronica.
Conclusioni
Negli ultimi decenni sono stati sviluppati diversi approcci terapeutici per il trattamento di patologie oculari considerate in precedenza difficilmente guaribili. Parte di questo successo si deve soprattutto alle tante evidenze sperimentali che hanno identificato nel processo infiammatorio un ruolo determinate e/o scatenante di diverse patologie oculari. A poco a poco, il campo d’intervento farmacologico/clinico si è aperto a nuove soluzioni terapeutiche molte delle quali si sono già consolidate nella pratica clinica, mentre altre si stanno ancora avviando ad essere esaminate o si trovano in una fase iniziale della sperimentazione oftalmica.
Un percorso è stato tracciato ed è auspicabile ritenere, sulla base dello scenario fin qui analizzato, che in futuro le opportunità per controllare con successo il processo infiammatorio oculare saranno sempre più elevate rispetto al passato.
Antonino Asero
E-mail: Antonino.Asero@sifigroup.com
Bibliografia
1. Streilein JW. Ocular immune privilege: therapeutic opportunities from an experiment of nature. Nat. Rev. Immunol. 2003 Nov;3(11):879-89.
2. McDermott, Perez V, Huang AJ, et al. 2005. Pathways of corneal and ocular surface inflammation: a perspective from the Cullen symposium. Ocul. 2005 Oct;3(4 Suppl):S131-8
3. Niederkorn JY, Stein-Streilein J. History and physiology of immune privilege. Ocul. Immunol. Inflamm. 2010 Jan;18(1):19-23.
4. Cheung CM, Vania M, Ang M, et al. Comparison of aqueous humor cytokine and chemokine levels in diabetic patients with and without retinopathy. Molecular Vision. 2012; 18:830-837.
5. Gronert K. Resolution, the grail for healthy ocular inflammation. Exp. Eye Res. 2010 Oct;91(4):478-85.
6. Alessandri AL, Sousa LP, Lucas CD, et al. Resolution of inflammation: mechanisms and opportunity for drug development. Pharmacol Ther. 2013 Aug;139(2):189-212
7. Gilroy DW, Lawrence T, Perretti M, et al. Inflammatory resolution: new opportunities for drug discovery. Nat Rev Drug Discov. 2004;3(5):401-16.
8. Rossi AG, Hallett JM, Sawatzky DA, et al. Modulation of granulocyte apoptosis can influence the resolution of inflammation. Biochem Soc Trans. 2007 Apr;35(Pt 2):288-91.
9. Hallett JM, Leitch AE, Riley NA, et al. Novel pharmacological strategies for driving inflammatory cell apoptosis and enhancing the resolution of inflammation. Trends Pharmacol Sci. 2008;29(5):250-7.
10. Serhan CN, Brain SD, Buckley CD, et al. Resolution of inflammation: state of the art, definitions and terms. FASEB J. 2007. 21, 325-332.
11. Duffin R, Leitch AE, Fox S. Targeting granulocyte apoptosis: mechanisms, models, and therapies. Immunol Rev. 2010 Jul;236:28-40.
12. Serhan CN. Resolution phase of inflammation: novel endogenous anti-inflammatory and proresolving lipid mediators and pathways. Annu Rev Immunol. 2007;25:101-37.
13. Serhan CN, Chiang N. Endogenous pro-resolving and anti-inflammatory lipid mediators: a new pharmacologic genus. Br J Pharmacol. 2008 Mar;153 Suppl 1:S200-S215.
14. Serhan CN, Chiang N, Van Dyke TE. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nat Rev Immunol. 2008 May;8(5):349-61.
15. Serhan CN, Petasis NA, 2011. Resolvins and protectins in inflammation resolution. Chem Rev. 2011 Oct 12;111(10):5922-43.
16. Levy BD, Zhang QY, Bonnans C, et al. The endogenous pro-resolving mediators lipoxin A4 and resolvin E1 preserve organ function in allograft rejection. Prostaglandins Leukot Essent Fatty Acids. 2011;84(1-2):43-50.
17. Souza DG, Fagundes CT, Amaral FA, et al. The required role of endogenously produced lipoxin A4 and annexin-1 for the production of IL-10 and inflammatory hyporesponsiveness in mice. J Immunol. 2007;15;179(12):8533-43.
18. Conte FP, Menezes-de-Lima O Jr., Verri WA Jr., et al. Lipoxin A(4) attenuates zymosan-induced arthritis by modulating endothelin-1 and its effects. Br J Pharmacol. 2010;161(4):911-24.
19. Serhan CN, Yang R, Martinod K, et al. Maresins: novel macrophage mediators with potent antiinflammatory and proresolving actions. J Exp Med. 2009;206, 15–23.
20. Schwab JM, Chiang N, Arita M, et al. Resolvin E1 and protectin D1 activate inflammation-resolution programmes. Nature Letters, 2008;447:869-75.
21. Chiang N, Fredman G, Backhed F, et al. Infection regulates pro-resolving mediators that lower antibiotic requirements. Nature. 2012;484: 524-528.
22. Xu ZZ, Zhang L, Liu T, et al. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med. 2010;16(5):592-7, 1p following 597.
23. Serhan CN, Hamberg M, Samuelsson B. Lipoxins: novel series of biologically active compounds formed from arachidonic acid in human leukocytes. Proc Natl Acad Sci USA. 1984; 81(17): 5335–5339.
24. Chiang N, Arita M, Serhan CN. Anti-inflammatory circuitry: lipoxin, aspirin-triggered lipoxins and their receptor ALX. Prostaglandins Leukot Essent Fatty Acids. 2005;73(3-4):163-77.
25. Chiang N, Serhan CN, Dahlén SE, et al. The lipoxin receptor ALX: potent ligand-specific and stereoselective actions in vivo. Pharmacol Rev. 2006;58(3):463-87.
26. Godson C, Brady HR. Lipoxins: novel anti-inflammatory therapeutics? Curr Opin Investig Drugs. 2000;1(3):380-5.
27. Maderna P, Godson C, Taking insult from injury: lipoxins and lipoxin receptor agonists and phagocytosis of apoptotic cells. Prostaglandins Leukot Essent Fatty Acids. 2005 Sep-Oct;73(3-4):179-87.
28. Fierro IM, Colgan SP, Bernasconi G, et al. Lipoxin A4 and aspirin-triggered 15-epi-lipoxin A4 inhibit human neutrophil migration: comparisons between synthetic 15 epimers in chemotaxis and transmigration with microvessel endothelial cells and epithelial cells. J Immunol. 2003 Mar 1;170(5):2688-94.
29. Gronert K. Lipoxins in the eye and their role in wound healing. Prostaglandins Leukot Essent Fatty Acids. 2005 Sep-Oct;73(3-4):221-9.
30. Bazan NG. Cell survival matters: docosahexaenoic acid signaling, neuroprotection and photoreceptors. Trends Neurosci. 2006;29,263- 271.
31. Biteman B, Hassan IR, Walker E, et al. Interdependence of lipoxin A4 and heme-oxygenase in counter-regulating inflammation during corneal wound healing. FASEB J. 2007 Jul;21(9):2257-66.
32. Qin Q, Patil KA, Gronert K, et al. Neuroprotectin D1 inhibits retinal ganglion cell death following axotomy. Prostaglandins Leukot. Essent. Fatty Acids. 2008; 79, 201-207.
33. Bazan NG, 2009. Neuroprotectin D1-mediated anti-inflammatory and survival signaling in stroke, retinal degenerations, and Alzheimer’s disease. J. Lipid. Res. 2009 Apr;50 (Suppl.), S400-S405
34. Calandria JM, Marcheselli VL, Mukherjee PK, et alSelective survival rescue in 15-lipoxygenase-1 deficient retinal pigment epithelial cells by the novel docosahexaenoic acid-derived mediator, neuroprotectin D1. J. Biol. Chem. 2009; 284, 17877-17882.
35. Kenchegowda S, Bazan HE. Significance of lipid mediators in corneal injury and repair. J Lipid Res. 2010 May;51(5):879-91.
36. Medeiros R, Rodrigues GB, Figueiredo CP, et al. Molecular mechanisms of topical anti-inflammatory effects of lipoxin A(4) in endotoxin-induced uveitis. Mol Pharmacol. 2008;74(1):154-61.
37. József L, Zouki C, Petasis NA, et al. Lipoxin A4 and aspirin-triggered 15-epi-lipoxin A4 inhibit peroxynitrite formation, NF-kappa B and AP-1 activation, and IL-8 gene expression in human leukocytes. Proc Natl Acad Sci U S A. 2002 Oct 1;99(20):13266-71.
38. Rodgers K, McMahon B, Mitchell D, et al. Lipoxin A4 modifies platelet-derived growth factor-induced pro-fibrotic gene expression in human renal mesangial cells, Am. J. Pathol. 2005;167 683–694.
39. Martins V, Valença SS, Farias-Filho F., et al. ATLa, an aspirin-triggered lipoxin A4 synthetic analog, prevents the inflammatory and fibrotic effects of bleomycin-induced pulmonary fibrosis, J. Immunol. 2009;182 5374–5381.
40. Guilford WJ, Parkinson JF Second-generation beta-oxidation resistant 3-oxa-lipoxin A4 analogs. Prostaglandins Leukot Essent Fatty Acids. 2005 Sep-Oct;73(3-4):245-50.
41. Serhan CN. The resolution of inflammation: the devil in the flask and in the details. The FASEB Journal. 2011 May; 25(5)1441-1448.
42. Haworth O, Cernadas M, Yang R, et al. Resolvin E1 regulates interleukin-23, interferon-gamma and lipoxin A4 to promote resolution of allergic airway inflammation. Nat Immunol 2008, 9:873-879.
43. Li N, He J, Schwartz CE, et al. Resolvin E1 improves tear production and decreases inflammation in a dry eye mouse model. J. Ocul. Pharmacol. Ther, 26, 431-439 (2010).
44. Zhang F, Yang H, Pan Z, et al. Dependence of resolvin-induced increases in corneal epithelial cell migration on EGF receptor transactivation. Invest Ophthalmol Vis Sci (2010b). 51, 5601–5609.
45. Dartt DA, Hodges RR, Li D, et al. Conjunctival Goblet Cell Secretion Stimulated by Leukotrienes Is Reduced by Resolvins D1 and E1 To Promote Resolution of Inflammation. J Immunol. 2011 Apr 1;186(7):4455-66.
46. de Paiva CS, Schwartz CE, Gjorstrup P, et al. Resolvin E1 (RX-10001) reduces corneal epithelial barrier disruption and protects against goblet cell loss in a murine model of dry eye. Cornea 2012;31:1299-1303.
47. Li D, Hodges RR, Jiao J, et al. Resolvin D1 and aspirin-triggered resolvin D1 regulate histamine-stimulated conjunctival goblet cell secretion. Mucosal Immunol. 2013;6(6):1119-30.
48. Krishnamoorthy S, Recchiuti A, Chiang N, et al. Resolvin D1 Receptor Stereoselectivity and Regulation of Inflammation and Proresolving MicroRNAs. Am J Pathol. 2012; 180(5): 2018–2027.
49. Tian H, Lu Y, Sherwood AM, et al. Resolvins E1 and D1 in Choroid-Retinal Endothelial Cells and Leukocytes: Biosynthesis and Mechanisms of Anti-inflammatory Actions. Invest. Ophthalmol. Vis. Sci. 2009; 50(8):3613-20.
50. Marcheselli VL, Hong S, Lukiw WJ, et al. Novel docosanoids inhibit brain ischemia–reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression. J Biol Chem. 2003. 278, 43807–43817.
51. Bannenberg GL, Chiang N, Ariel A, et al. Molecular circuits of resolution: formation and actions of resolvins and protectins. J Immunol. 2005; 174, 4345–4355.
52. Duffield JS, Hong S, Vaidya VS, et al. Resolvin D series and protectin D1 mitigate acute kidney injury. J Immunol. 2006;177, 5902–5911.
53. Levy BD, Kohli P, Gotlinger K, et al. Protectin D1 is generated in asthma and dampens airway inflammation and hyperresponsiveness. J Immunol. 2007. 178, 496–502.
54. Bazan NG. Neuroprotectin D1 (NPD1): a DHA-derived mediator that protects brain and retina against cell injury-induced oxidative stress. Brain Pathol. 2005;15(2):159-66.
55. Mukherjee PK, Marcheselli VL, Serhan CN, et al. Neuroprotectin D1: A docosahexaenoic acid-derived docosatriene protects human retinal pigment epithelial cells from oxidative stress. PNAS, 2004;101(22):8491-8496.
56. Calandria JM, Mukherjee PK, de Rivero Vaccari JC, et al. Ataxin-1 Poly(Q)-induced proteotoxic stress and apoptosis are attenuated in neural cells by docosahexaenoic acid-derived Neuroprotectin D1. J Biol Chem, 2012;287:23726-39.
57. Cortina MS, He J, Russ T, et al. Neuroprotectin D1 restores corneal nerve integrity and function after damage from experimental surgery. Invest Ophthalmol Vis Sci. 2013;54:4109–4116.
58. Serhan CN, Dalli J, Karamnov S, et al. Macrophage proresolving mediator maresin 1 stimulates tissue regeneration and controls pain. FASEB J. 2012;26(4):1755-65.
59. Lacotte S, Brun S, Muller S, et al. CXCR3, inflammation, and autoimmune diseases. Ann N Y Acad Sci. 2009;1173:310-7.
60. Wijtmans M, Verzijl D, Leurs R, et al. Towards small-molecule CXCR3 ligands with clinical potential. Chem Med Chem 2008, 3:861-872.
61. Crosignani S, Missotten M, Cleva C, et al. Discovery of a novel series of CXCR3 antagonists. Bioorg Med Chem Lett 2010, 20:3614-3617.
62. Jenh CH, Cox MA, Cui L, et al.: A selective and potent CXCR3 antagonist SCH 546738 attenuates the development of autoimmune diseases and delays graft rejection. BMC Immunol. 2012 Jan 10;13(1):2.
63. Yoon KC, Park CS, You IC, et al. Expression of CXCL9, -10, -11, and CXCR3 in the tear film and ocular surface of patients with dry eye syndrome. Invest Ophthalmol Vis Sci. 2010;51: 643–650.
64. Coursey TG., Gandhi NB, Volpe EA, et al. Chemokine Receptors CCR6 and CXCR3 Are Necessary for CD4+ T Cell Mediated Ocular Surface Disease in Experimental Dry Eye Disease. Plos One. 2013;8;11, e78508.
65. Perez VL, Saeed AM, Tan Y, et al. The eye: A window to the soul of the immune system. J Autoimmun. 2013 Sep;45:7-14.
66. Gao P, Zhou XY, Yashiro-Ohtani Y, et al. The unique target specificity of a nonpeptide chemokine receptor antagonist: selective blockade of two Th1 chemokine receptors CCR5 and CXCR3. J Leukoc Biol 2003;73:273-80.
67. Sennlaub F, Auvynet C, Calippe B, et al. CCR2(+) monocytes infiltrate atrophic lesions in age-related macular disease and mediate photoreceptor degeneration in experimental subretinal inflammation in Cx3cr1 deficient mice. EMBO Mol Med. 2013 Nov;5(11):1775-93
68. Sousa LP, Alessandri AL, Pinho V, et al. Pharmacological strategies to resolve acute inflammation. Current Opinion in Pharmacology, 2013; 13: 1-7.
69. Teixeira MM, Gristwood RW, Cooper N, et al. Phosphodiesterase (PDE)4 inhibitors: anti-inflammatory drugs of the future? Trends Pharmacol Sci 1997, 18:164-171.
70. Sousa LP, Carmo AF, Rezende BM, et al. Cyclic amp enhances resolution of allergic pleurisy by promoting inflammatory cell apoptosis via inhibition of PI3K/ Akt and NF-kappaB. Biochem Pharmacol 2009, 78:396-405.
71. Sousa LP, Lopes F, Silva DM, et al. PdE4 inhibition drives resolution of neutrophilic inflammation by inducing apoptosis in a PKA-PI3K/Akt- dependent and NF-kappa B-independent manner. J Leukoc Biol 2010, 87:895-904.
72. Bystrom J, Evans I, Newson J, et al. Resolution-phase macrophages possess a unique inflammatory phenotype that is controlled by cAMP. Blood 2008, 112:4117-4127.
73. Rajakariar R, Newson J, Jackson EK, et al. Nonresolving inflammation in gp91phoxS/S mice, a model of human chronic granulomatous disease, has lower adenosine and cyclic adenosine 50-monophosphate. J Immunol 2009, 182:3262-3269.
74. Gale DC, Sychterz CJ, Rodgers C, et al. Ocular and Systemic Pharmacokinetics of a PDE4 Inhibitor Following Topical Administration (Eyedrop) in Male Dutch-Belted Rabbits. ARVO abstract n.5060, 2013.
75. Forrester JV, Steptoe RJ, Klaska IP, et al. Cell-based therapies for ocular inflammation. Prog Retin Eye Res. 2013 Jul;35:82-101.
76. Medina RJ, Archer DB, Stitt, AW. Eyes open to stem cells: safety trial may pave the way for cell therapy to treat retinal disease in patients. Stem Cell Res Ther. 2011 Dec 7;2(6):47.
77. Vasania VS, Prasad P, Gill RK, et al. Molecular and cellular characterization of expanded and cryopreserved human limbal epithelial stem cells reveal unique immunological properties. Exp. Eye Res. 2011;92, 47-56.
78. Zhang, X, Ren X, Li G, et al. Mesenchymal stem cells ameliorate experimental autoimmune uveoretinitis by comprehensive modulation of systemic autoimmunity. Invest. Ophthalmol. Vis. Sci. 2011; 52, 3143-3152.
79. Oh JY, Roddy GW, Choi H, et al. Anti-inflammatory protein TSG-6 reduces inflammatory damage to the cornea following chemical and mechanical injury. Proc. Natl. Acad. Sci. U. S. A. 2010; 107, 16875-16880.
80. Roddy GW, Oh JY, Lee R, et al. Action at a distance: systemically administered adult stem/progenitor cells (MSCs) reduce inflammatory damage to the cornea without engraftment and primarily by secretion of TNF-alpha stimulated gene/protein 6. Stem Cells. 2011;29, 1572-1579.
81. Ortega-Gómez A, Perretti M, Soehnlein O. Resolution of inflammation: an integrated view EMBO Mol Med. 2013; 5(5): 661–674.
82. Forrester JV, Mcmenamin PG, Holthouse I, et al. Localization and characterization of major histocompatibility complex class IIpositive cells in the posterior segment of the eye: implications for induction of autoimmune uveoretinitis. Invest. Ophthalmol. Vis. Sci. 1994; 35, 64-77.
83. Forrester JV, Huitinga I, Lumsden L, et al. Marrow-derived activated macrophages are required during the effector phase of experimental autoimmune uveoretinitis in rats. Curr. Eye Res. 1998;17, 426-437.
84. Jiang HR, Lumsden L, Forrester JV. Macrophages and dendritic cells in IRBP-induced experimental autoimmune uveoretinitis in B10RIII mice. Invest. Ophthalmol. Vis. Sci. 1999;40, 3177-3185.
85. Dick AD, Mcmenamin PG, Korner H, et al. Inhibition of tumor necrosis factor activity minimizes target organ damage in experimental autoimmune uveoretinitis despite quantitatively normal activated T cell traffic to the retina. Eur. J. Immunol. 1996; 26,1018-1025.
86. Dick AD, Carter D, Robertson M, et al. Control of myeloid activity during retinal inflammation. J Leukoc Biol. 2003 Aug;74(2):161-6.
87. Dick AD, Forrester JV, Liversidge J, et al. The role of tumour necrosis factor (TNF-alpha) in experimental autoimmune uveoretinitis (EAU). Prog. Retin. Eye Res. 2004;23, 617-637.
88. Zhu B, Bando Y, Xiao S, et al. CD11b+ Ly-6C(hi) suppressive monocytes in experimental autoimmune encephalomyelitis. J. Immunol. 2007; 179, 5228-5237.
89. Moline-Velazquez V, Cuervo H, Vila-Del Sol V, et al. Myeloid-derived suppressor cells limit the inflammation by promoting T lymphocyte apoptosis in the spinal cord of a murine model of multiple sclerosis. Brain Pathol. 2011; 21, 678-691.
90. Ray P, Arora M, Poe SL, et al. Lung myeloid-derived suppressor cells and regulation of inflammation. Immunol. Res. 2011; 50, 153-158.
91. Tu Z, Li Y, Smith D, et al. Myeloid suppressor cells induced by retinal pigment epithelial cells inhibit autoreactive T cell responses that lead to experimental autoimmune uveitis. Invest. Ophthalmol. Vis. Sci. 2012; 53, 959-966.
92. Kerr EC, Raveney BJ, Copland DA, et al. Analysis of retinal cellular infiltrate in experimental autoimmune uveoretinitis reveals multiple regulatory cell populations. J Autoimmun. 2008;31:354–361.
93. Obermajer N, Kalinski P. Generation of myeloid-derived suppressor cells using prostaglandin E2. Transplantation Research 2012, 1:15.
94. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061.
95. Asseman C, Mauze S, Leach MW, et al. An essential role for interleukin 10 in the function of regulatory T cells that inhibit intestinal inflammation. J Exp Med .1999;190: 995-1004.
96. Fahlen L, Read S, Gorelik L, et al. T cells that cannot respond to TGF-beta escape control by CD4(+)CD25(+) regulatory T cells. J Exp Med. 2005; 201: 737-746.
97. Cao D, Malmstrom V, Baecher-Allan C, et al. Isolation and functional characterization of regulatory CD25brightCD4+ T cells from the target organ of patients with rheumatoid arthritis. Eur J Immunol. 2003; 33: 215-223.
98. Viglietta V, Baecher-Allan C, Weiner HL, et al. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J Exp Med. 2004;199: 971-979.
99. Ait-Oufella H, Salomon BL, Potteaux S, et al. Natural regulatory T cells control the development of atherosclerosis in mice. Nat Med. 2006;12: 178-180.
100. Trzonkowski P, Bieniaszewska M, Juscinska J, et al. First-in-man clinical results of the treatment of patients with graft versus host disease with human ex vivo expanded CD4+CD25+CD127-T regulatory cells. Clin Immunol 2009; 133(1):22–26.
101. Brunstein CG, Miller JS, Cao Q, et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: Safety profile and detection kinetics. Blood 2010; 117:1061–1070.
102. Di Ianni M, Falzetti F, Carotti A, et al. Tregs prevent GVHD and promote immune reconstitution in HLA-haploidentical transplantation. Blood. 2011; 117: 3921–3928.
103. Marek-Trzonkowska N, My?liwec M, Siebert J, et al. Clinical application of regulatory T cells in type 1 diabetes. Pediatr Diabetes. 2013;14(5):322-32.
104. Chen L, Yang P, Zhou H, et al. Diminished frequency and function of CD4+CD25 high regulatory T cells associated with active uveitis in Vogt-Koyanagi-Harada syndrome. Invest. Ophthalmol. Vis. Sci. 2008; 49, 3475-3482.
105. Nanke Y, Kotake S, Goto M, et al. Decreased percentages of regulatory T cells in peripheral blood of patients with Behcet’s disease before ocular attack: a possible predictive marker of ocular attack. Mod. Rheumatol. 2008; 18, 354-358.
106. Yeh S, Li Z, Forooghian F, et al. CD4+Foxp3+ T-regulatory cells in noninfectious uveitis. Arch Ophthalmol. 2009 Apr;127(4):407-13.
107. Larson T, Nussenblatt RB, Sen HN. Emerging drugs for uveitis. Expert Opin. Emerg. Drugs. 2011;16, 309-322.
108. Calleja S, Cordero-Coma M, Rodriguez E, et al. Adalimumab specifically induces CD3(+) CD4(+) CD25(high) Foxp3(+) CD127(-) T-regulatory cells and decreases vascular endothelial growth factor plasma levels in refractory immuno-mediated uveitis: a non-randomized pilot intervention study. Eye (Lond) 2012: 26, 468-477.
109. Riley JL, June CH, Blazar BR. Human T Regulatory Cells as Therapeutic Agents: Take a Billion or So of These and Call Me in the Morning. Immunity. 2009; 30(5): 656–665.
110. Brunstein CG, Fuchs EJ, Carter SL, et al. Alternative donor transplantation after reduced intensity conditioning: results of parallel phase 2 trials using partially HLA-mismatched related bone marrow or unrelated double umbilical cord blood grafts. Blood. 2011;118, 282-288.
111. Sagoo P, Ali N, Garg G, et al. Human regulatory T cells with alloantigen specificity are more potent inhibitors of alloimmune skin graft damage than polyclonal regulatory T cells. Sci Transl Med 2011; 3: 83ra42.
112. Peters JH, Hilbrands LB, Koenen HJ, et al. Ex vivo generation of human alloantigen-specific regulatory T cells from CD4(pos) CD25(high) T cells for immunotherapy. PLoS ONE 2008; 3: 2233.
113. Koenen HJ, Fasse E, Joosten I. CD27/CFSE-based ex vivo selection of highly suppressive alloantigen-specific human regulatory T cells. J Immunol 2005; 174: 7573–7583.
114. Banerjee DK, Dhodapkar MV, Matayeva E, et al. Expansion of FOXP3high regulatory T cells by human dendritic cells (DCs) in vitro and after injection of cytokinematured DCs in myeloma patients. Blood 2006; 108: 2655–2661.
115. Putnam AL, Safinia N, Medvec A, et al. Tang. Clinical Grade Manufacturing of Human Alloantigen-Reactive Regulatory T Cells for Use in Transplantation. American Journal of Transplantation 2013; 13(11):3010-20.
Dr. Carmelo Chines
Direttore responsabile
