I nuovi potenziali terapeutici delle cellule staminali in oftalmologia.
I recenti avanzamenti in medicina rigenerativa, in particolare le terapie basate sull’uso di colture autologhe di cellule staminali adulte, e le prime sperimentazioni cliniche recentemente proposte con cellule staminali pluripotenti, hanno generato entusiasmo e molti sforzi per esplorare i nuovi potenziali terapeutici sia delle cellule staminali adulte sia pluripotenti.
Negli ultimi decenni, la biologia dello sviluppo ha chiarito molti meccanismi cellulari e molecolari, che regolano l’omeostasi dei tessuti dipendente dalle cellule staminali, rendendoci edotti sulle basi molecolari di molte patologie. Molti tessuti e organi umani possiedono la capacità di auto rinnovarsi e riparare lesioni acute e croniche. Questi processi si fondano sulla presenza di specifiche cellule staminali, che generano progenitori (spesso definite cellule che amplificano in maniera transiente), le quali generano cellule terminalmente differenziate. Esempi tipici di queste transizioni, sono le cellule staminali ematopoietiche, che danno origine a tutte le cellule del sangue attraverso progenitori mieloidi e linfoidi, o le cellule staminali epidermiche, che danno origine alla epidermide, al follicolo pilifero e alle ghiandole sebacee; le cellule staminali mesenchimali, che derivano dal midollo osseo, sono capaci di generare tutti i tessuti trovati nel segmento osseo (ossa, cartilagine, adipociti, fibroblasti e lo stroma che supporta l’ematopoiesi), meglio definite cellule staminali scheletriche.
dell’epitelio corneale, hanno dimostrato di ripristinare completamente un epitelio corneale gravemente danneggiato e consentire il recupero della visione in pazienti con distruzione corneale causata da ustioni chimiche. Le cellule staminali sono isolate mediante trattamento enzimatico, da una biopsia di 1-2 mm di limbus, la sottile zona tra cornea e congiuntiva. Il limbus è la sola zona corneale con invaginazioni simili a papille, chiamate Palizzate di Vogt e cripte epiteliali limbari, contenenti molte cellule basali piccole che mancano della cheratina 3, specifica del differenziamento corneale. Questo strato basale limbare contiene cellule che completano lentamente il ciclo cellulare e che formano olocloni, mentre le cellule corneali centrali non li contengono. Sono stati proposti molti marcatori molecolari per identificare le cellule staminali corneali, tuttavia è stata dimostrata la correlazione con la capacità di rigenerare la cornea nel lungo termine, solo per pochi di essi.
Poco dopo il primo resoconto di applicazione clinica di successo, con cellule staminali limbari coltivate, diverse decine di protocolli simili sono stati proposti con le relative applicazioni cliniche. Indagini su metodi alternativi e patologie eleggibili per il trattamento, hanno contribuito ad aumentare la nostra conoscenza in questo settore, mentre aumentavano le domande legate alla identificazione delle cause di variabilità legate ai reagenti utilizzati per la ricostruzione del tessuto, alla selezione dei pazienti inclusi nel trattamento, ai farmaci utilizzati in parallelo, alla gestione chirurgica e post-operatoria e le relative implicazioni sulla quota di esiti positivi, sulla sicurezza e riproducibilità degli esiti clinici.
La separazione culturale tra diversi settori scientifici rende difficile stabilire criteri multidisciplinari che sono, tuttavia, necessari per una traslazione ottimale della ricerca. In quest’articolo si vuole tentare di proporre alcuni criteri (specificamente correlati sia a parametri clinici che biologici) per la medicina traslazionale con cellule staminali limbari coltivate.
Vi proponiamo anche un’ampia bibliografia che possa fare da guida a chi desiderasse conoscere meglio questo settore di ricerca.
Selezione dei pazienti
L’insieme delle cellule staminali limbari dell’epitelio corneale diminuisce a causa di danni ereditari o acquisiti, che conducono a deficit parziale o totale di cellule staminali limbari (LSCD). Questa definizione si riferisce a un gruppo eterogeneo di patologie che hanno un effetto deleterio sulla integrità corneale e sulla chiusura delle ferite. Come conseguenza della deplezione di cellule staminali, si verifica un’invasione della cornea periferica e centrale da parte dell’epitelio congiuntivale. Questa delocalizzazione di tessuto induce la neovascolarizzazione di un’area oculare normalmente avascolare e induce opacizzazione corneale, provocando un forte calo di acuità visiva o cecità. L’invasione congiuntivale può essere prevenuta o impedita mediante la rilocalizzazione delle cellule staminali corneali ottenuta tramite il trapianto di lembi generati dalla coltura di cellule limbari autologhe, prelevate dall’occhio non danneggiato o meno danneggiato.
[caption id="attachment_1536" align="alignright" width="178"]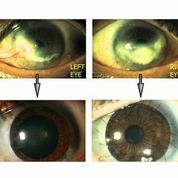 Ph. 2. LSD bilaterale prima e dopo il trattamento (per concessione del Dott. Paolo Rama).[/caption]
Ph. 2. LSD bilaterale prima e dopo il trattamento (per concessione del Dott. Paolo Rama).[/caption]
La selezione appropriata e la preparazione del “letto ricevente” sono di grande importanza per un risultato clinico positivo delle colture limbari. I fallimenti possono avvenire a causa della gravità del danno, del grado d’infiammazione e delle complicanze post-operatorie. Le ustioni chimiche possono danneggiare le palpebre, la congiuntiva e l’apparato lacrimale. Nel corso di un tale danneggiamento, la superficie oculare è cronicamente infiammata e la risultante alterazione del microambiente può impedire l’attecchimento delle cellule staminali coltivate. Nel caso di ampi danni dell’intera superficie oculare, la ricostruzione della congiuntiva che consente il movimento del bulbo oculare e la distribuzione fisiologica del film lacrimale, devono essere ottenuti prima del trapianto di cellule. In assenza di stimoli negativi sistemici o genetici, il trapianto di colture autologhe di cellule limbari può esso stesso ripristinare parzialmente o totalmente il macro o micro-ambiente. Questo può spiegare perché, in superfici oculari gravemente danneggiate da ustioni chimiche, il secondo trapianto di epitelio coltivato produce un grado di successo più alto del primo trapianto. Il primo trapianto di cellule coltivate probabilmente “normalizza l’ambiente” attraverso la produzione di molecole della matrice come la laminina 5, i proteoglicani e il collagene, la secrezione paracrina e autocrina di una quantità bilanciata di fattori di crescita, come TGF alfa, interleuchine, PDGF, Insulin like Growth Factor 1, TGF beta, Nerve Growth Factor, basic Fibroblasts Growth Factor, e il “cross-talk” epiteliale – mesenchimale. Nonostante i molti anni di comprovato successo clinico, ancora non abbiamo la percezione di quante cellule staminali possono attecchire sul letto ricevente della lesione. Inoltre, le patologie della superficie oculare, attribuite al deficit di cellule staminali limbari, possono avere una varietà di eziologie ma, non per tutte, è dimostrato che siano associate a una totale deplezione di cellule staminali limbari. Infatti, potrebbero essere caratterizzate da un macro- e micro-ambiente non permissivo per un’appropriata proliferazione e differenziamento delle cellule staminali esistenti. Le varietà di deficit limbari potrebbero fornire “istruzioni di comportamento” alle cellule trapiantate, che guidano diverse risposte cellulari durante o dopo l’attecchimento.
Parametri Biologici
Sono stati proposti diversi metodi per la coltura di cellule staminali limbari. La composizione del terreno di coltura gioca un ruolo importante nel preservare le cellule staminali limbari, e sono state proposte diverse miscele di materiali e reagenti per la coltura. Tra le varie proposte, non è chiaro quando siano state applicate le Norme di Buona Fabbricazione o GMP (entrate in vigore in Europa per questi prodotti) ai reagenti biologici destinati alla fabbricazione di terapie avanzate (tessuti coltivati).
[caption id="attachment_1537" align="alignleft" width="178"]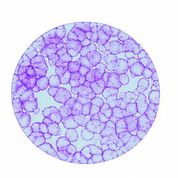 Ph. 3. Colonie di cellule epiteliali ottenute da una cellula staminale (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
Ph. 3. Colonie di cellule epiteliali ottenute da una cellula staminale (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
Di fatto, anche i dettagli sui criteri utilizzati per la scelta di materiali e reagenti appropriati, non è stata regolarmente descritta e non è stato mai spiegato come questi materiali siano stati considerati idonei a mantenere in coltura le cellule staminali. In assenza di questi dati, diventa difficile valutare la quota di successi clinici o la sicurezza di ciascun sistema di coltura sviluppato, e se le differenze siano legate alla tecnica di coltura o alla selezione dei singoli lotti di reagenti. Ovviamente, il confronto tra diverse condizioni di coltura non può evidenziare differenze qualora le cellule staminali non siano state mantenute in nessuna delle condizioni.
Negli anni passati, svariati studi hanno proposto differenti combinazioni di fattori di crescita e ormoni nel terreno di coltura. Questi terreni possono indurre stimolazioni di diverse vie metaboliche con varietà di risposte cellulari sia in coltura che dopo trapianto. Per produrre il successo clinico, una coltura di cellule corneali deve contenere un numero sufficiente di cellule staminali dei cheratinociti, essenziali per il rinnovamento di lungo termine della cornea, più che un epitelio completamente stratificato in coltura. I risultati clinici ottenuti con tecniche differenti potranno contribuire a identificare le informazioni chiave sulla appropriatezza del processo di coltura.
Il problema dei componenti xenogenici
[caption id="attachment_1538" align="alignright" width="263"]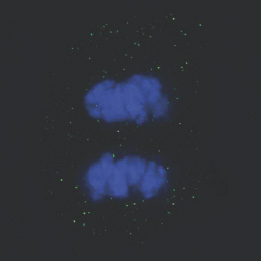 Ph. 5. Una cellula limbare in mitosi (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
Ph. 5. Una cellula limbare in mitosi (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
I terreni di coltura, spesso contengono materiali di derivazione animale, come il siero bovino. Il siero fetale è utilizzato in questo, così come in altri modelli di colture cellulari. Alcuni autori hanno proposto l’utilizzo del siero umano autologo, con l’intento di prevenire putativi contaminanti xenogenici, per sostituire il siero bovino fetale. È, tuttavia, necessario considerare il contenuto variabile di ormoni e fattori di crescita, dovuto alle diverse caratteristiche genetiche di ciascun individuo, che renderebbero le colture non riproducibili, poiché crescerebbero in terreni di coltura a composizione diversa per ogni paziente. Queste differenze possono avere un impatto sul mantenimento delle cellule staminali, e ridurrebbero l’affidabilità dei controlli sulle colture rendendo impossibile la definizione di criteri specifici e ben definiti per valutare la qualità della coltura cellulare. Il siero fetale bovino, frequentemente utilizzato, deriva da miscele di sieri diversi, pertanto la variabilità individuale di contenuto è minimizzata; certamente il siero fetale utilizzato deve essere analizzato estensivamente per assenza di patogeni, in accordo alle normative sanitarie vigenti. Un equivalente uso di miscele di sieri umani potrebbe ovviare la variabilità individuale tuttavia, il rischio di contaminazioni da parte di virus, agenti infettivi o virali e prioni esiste anche per i reagenti di origine umana e, soprattutto in assenza di barriere di specie, tutto può essere trasmesso.
[caption id="attachment_1539" align="alignleft" width="178"]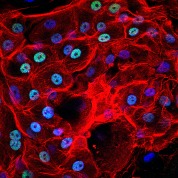 Ph. 5. Cellule corneali viste al microscopio a fluorescenza (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
Ph. 5. Cellule corneali viste al microscopio a fluorescenza (per concessione del Centro di Medicina Rigenerativa “Stefano Ferrari”).[/caption]
Un’altra scelta proposta, sono i terreni di coltura sintetici che, tuttavia, mancano di un enorme numero di stimolatori fisiologici, parte dei quali sono noti e potrebbero in futuro essere prodotti mediante sintesi e aggiunti. Va considerato però che molti di questi sono ancora ignoti e la purificazione (in condizioni GMP) di tutti gli ormoni e fattori di crescita necessari renderebbe il costo dei terreni inaffrontabile. Analoghe considerazioni valgono per molti altri elementi dei terreni di coltura, spesso di origine animale e non ancora sostituibili se si vogliono mantenere le funzioni cellulari, che devono essere accuratamente controllati prima dell’uso.
I segnali biomeccanici e la modifica delle superfici
Una tipica strategia, utilizzata nelle terapie basate su cellule staminali, consiste nel ricostruire tessuti ingegnerizzati con cellule cresciute su biomateriali in grado di “mimare” il microambiente biochimico e biofisico in vivo. A questo scopo sono stati proposti molti materiali differenti per coltivare le cellule, come la fibrina, la membrana amniotica, la plastica o polimeri di varia natura. L’interazione tra le cellule staminali, il microambiente che le circonda e le forze esterne (che rappresentano “la nicchia” delle cellule staminali) devono essere compresi bene, prima di procedere all’applicazione clinica delle terapie. Il comportamento cellulare non è governato solo da segnali di tipo chimico. Architettura dei tessuti e forze meccaniche, a cui sono sottoposti, sono segnali dominanti che governano le decisioni cellulari: le interazioni cellula-matrice e adesione cellula-cellula, l’organizzazione del citoscheletro, e le forze di tensione che mantengono le cellule individuali e l’intero tessuto in una precisa forma, rappresentano tutte, segnali “di architettura” biologica. Le connessioni meccaniche tra la matrice e il citoscheletro consentono alle cellule di esercitare forze di trazione che sono trasmesse al nucleo cellulare il cui risultato è l’innesco di segnali, che modulano l’adesione, la diffusione sulle superfici, la migrazione, la proliferazione e il differenziamento. Più in generale, la meccano-trasduzione rappresenta una combinazione di segnali, che includono la contrapposizione di stimoli molecolari, topografici e meccanici, presenti alla interfaccia d’interazione. Per studiare queste interazioni, sono state usate superfici che esponevano gruppi molecolari bio-funzionali selezionati o stampi-guida su scala micrometrica, specificamente ingegnerizzate. Queste prove hanno evidenziato che la durezza del substrato, la nano topografia di superficie, la micro geometria e le forze extracellulari e anche i flussi di liquidi, possono tutti avere un’influenza importante sulla regolazione delle attività di diversi tipi cellulari. Per esempio, in vivo, la formazione di cicatrici cutanee attiva la segnalazione dei Transforming Growth Factors e SMAD, molecole di adesione come le integrine e i segnali del calcio; oppure nel caso di mioblasti, se adagiati su ampie strisce d’idrogel morbido, diminuiscono la loro proliferazione e aumentano il loro indice di fusione.
Farmaci durante la chirurgia e il follow-up
La gestione di problemi post-traumatici o post-operatori prevede un uso estensivo di farmaci. Nel caso di trattamento per la risoluzione di deficit staminale limbare, l’impatto della tossicità corneale acuta e cronica di componenti delle gocce per instillazioni oculari non viene adeguatamente considerato nei protocolli di medicina rigenerativa. Malgrado ciò, un ampio numero di studi sperimentali e clinici hanno mostrato che l’uso prolungato di farmaci topici può indurre modificazioni della superficie oculare, causando disagio oculare, instabilità del film lacrimale, perdita di cellule caliciformi, infiammazione, metaplasia squamosa congiuntivale, apoptosi epiteliale, fibrosi subcongiuntivale. L’uso prolungato di anestetici locali è associato a ritardo della ri-epitelizzazione corneale dopo lesioni, lubrificazione e film lacrimale alterati, rigonfiamento corneale e interruzione della motilità epiteliale. La lidocaina, uno degli anestetici più comunemente usati, già alla dose di 250 mg/ml (al di sotto della dose clinica), riduce l’efficacia di una normale guarigione di ferite. I vasocostrittori, che sono utilizzati generalmente per aumentare la durata dell’anestesia locale, possono produrre un effetto citotossico e la deposizione di pigmenti, come riportato in letteratura per l’epinefrina e alcuni farmaci antiglaucoma comunemente usati.
In dipendenza dal dosaggio e dalle modalità di somministrazione, i corticosteroidi, ampiamente utilizzati, sia per uso sistemico che topico, nel trattamento di condizioni infiammatorie oculari, hanno effetti collaterali che includono ritardo o impedimento della chiusura di lesioni corneali. I farmaci antinfiammatori non steroidei inibiscono la sintesi di prostaglandine ed esercitano un effetto antinfiammatorio equivalente. Questi farmaci sono sempre più utilizzati per il loro concomitante effetto analgesico e la loro efficacia in patologie allergiche oculari.
L’analisi comparativa della tossicità corneale ha rivelato danno cellulare, alterata vitalità cellulare, proliferazione e migrazione anche dopo esposizione di breve durata, delle cellule corneali, ad alcuni farmaci antiinfiammatori non steroidei. Altri farmaci comunemente usati, come gli analoghi delle prostaglandine, gocce antiallergiche o soluzioni multiuso (soprattutto in presenza di conservanti) hanno mostrato effetti tossici simili. In particolare, i dati scientifici suggeriscono una interpretazione di danno irreversibile del compartimento proliferativo epiteliale, che include le cellule staminali; sono stati descritti effetti sulla vitalità cellulare (con un calo fino al 40%), sulla proliferazione, sul mantenimento dello spessore corneale, sulla permeabilità dell’endotelio, sull’integrità del DNA e sulla lubrificazione, dovuti a conservanti comuni come il cloruro di benzalconio (BAC), specialmente in caso di somministrazione ripetuta o persistenza di questi farmaci su superfici oculari danneggiate.
È chiaro che tutti questi effetti tossici sono amplificati quando i farmaci sono usati prima dell’attecchimento pieno di una popolazione di cellule coltivate.
In conclusione, nessun farmaco appare privo di tossicità di qualche tipo, pertanto deve essere attentamente valutata la selezione di farmaci sulle colture cellulari applicate e la armonizzazione di dosaggi e protocolli di somministrazione, per aumentare il rapporto beneficio/rischio.
Conclusioni
I rapidi avanzamenti nella ricerca sulle cellule staminali hanno sollevato l’interesse di governi, mezzi di comunicazione e, ovviamente, pazienti. Il loro successo clinico dipende da fattori unici per le terapie cellulari, che includono le procedure di fabbricazione, la standardizzazione di protocolli clinici e farmacologici, e la regolamentazione di sicurezza. Come già discusso, un’applicazione clinica di successo di qualsiasi protocollo di terapia cellulare richiede ottimizzazione del metodo di coltura (soprattutto quando sono necessarie le cellule staminali) e delle procedure chirurgiche, il controllo del microambiente su cui le cellule devono attecchire e un appropriato supporto farmacologico.
Questo scenario è ulteriormente complicato dalle nuove regolamentazioni sulle applicazioni cliniche di cellule e tessuti. Come con molti farmaci tradizionali, le colture cellulari destinate ad applicazione clinica devono essere ottenute in accordo con le Norme di Buona Fabbricazione (GMP) correnti, ma le colture cellulari sono intrinsecamente più complesse e meno ben controllabili che una piccola molecola. A causa della loro natura biologica, i prodotti a base di cellule viventi non possono essere pienamente definiti, con le stesse metodiche dei farmaci tradizionali. La scelta di applicare le regole dei prodotti medicinali alle colture cellulari, senza adeguamenti specifici per questo settore, non è completamente condivisibile. Infatti questa scelta crea problemi sia agli scienziati che ai regolatori. I ricercatori, provenienti sia da Accademia che da Industria, possono difficilmente far fronte alle nuove regole europee sugli ATMP (Advanced Therapy Medicinal Products) (EC regulation n°1394). Una regolamentazione simile, ma non identica, è stata applicata negli Stati Uniti e in altri paesi industrializzati.
I prodotti basati su cellule viventi presentano molte sfide aggiuntive specialmente nell’ambiente sanitario altamente regolato dei giorni nostri, soprattutto considerando che la rete di regole è stata ideata per le fabbricazioni di tipo chimico nel secolo scorso. In aggiunta, non c’è molta armonizzazione tra le diverse autorità regolatorie, e questo aumenta molto i problemi nella produzione e nelle sperimentazioni cliniche. La conferenza internazionale per l’armonizzazione dei requisiti tecnici per la registrazione di prodotti farmaceutici per uso umano, ha prodotto accordi solo su specifici argomenti, come la sicurezza virale e pochi altri.
La regolamentazione ha lo scopo di aumentare la sicurezza, quindi di proteggere i pazienti, ed è indiscutibile; tuttavia per prodotti basati su cellule viventi, viene spesso raggiunta a spese dell’efficacia, per mancanza di adeguamenti specifici per questo settore. Ogni terapia è basata su un rapporto beneficio/rischio, pertanto riducendo l’efficacia di una coltura cellulare sotto un certo valore soglia, genererà un prodotto biologico più sicuro ma inutile. Le terapie fondate sull’uso di cellule viventi, sono più complesse e intrinsecamente meno controllate della sintesi di molecole, a causa della loro natura biologica, rendendo questo prodotto non completamente ma solo parzialmente definito, secondo le regolamentazioni “classiche”, che richiedono per questi motivi, un ampliamento. Infine, molti prodotti di cellule autologhe paziente-specifici sono “somministrati freschi”, pertanto le analisi di rilascio non possono essere tutte completate prima della somministrazione, guidandoci verso l’idea che il vero prodotto è il processo di produzione e l’affidabilità della fabbricazione dovrebbe essere periodicamente valutata attraverso il confronto con cellule specifiche di riferimento, determinando i limiti per i controlli che vengono ottenuti durante la fabbricazione dei tessuti. Questi limiti saranno più ampi per la produzione di tessuti da diversi individui, a causa delle differenze di età, sesso, stile di vita, caratteristiche genetiche individuali, ma dovranno essere più stretti per trattamenti da donatore effettuati su larga scala.
Una comprensione delle prospettive della medicina rigenerativa offrirà una visione sulla probabile futura forma delle nuove terapie, sui loro tempi di sviluppo, così come sulla pianificazione delle infrastrutture necessarie per facilitare la sua spedita distribuzione da parte di Accademie e dalla nuova Industria Farmaceutica in tutto il mondo, con le massime garanzie per i pazienti.
Graziella Pellegrini
E-mail: graziella.pellegrini@unimore.it
Prof. Graziella Pellegrini è Docente di Biologia presso l’Università degli Studi di Modena e Reggio Emilia e Coordinatrice della Terapia Cellulare presso il Centro di Medicina Rigenerativa “Stefano Ferrari”, la prof.ssa Pellegrini ha dedicato gran parte della sua attività scientifica alla medicina traslazionale e allo sviluppo delle applicazioni cliniche delle cellule staminali coltivate.
Ha messo a punto insieme al Prof. Michele De Luca il primo trattamento con cellule staminali limbari umane per pazienti con gravi ustioni corneali.
È tra i membri fondatori dello IOSS (International Ocular Surface Society).
Riferimenti bibliografici
1. Wu SM, Hochedlinger K. Harnessing the potential of induced pluripotent stem cells for regenerative medicine. Nat Cell Biol.13:497-505.
2. Wagers AJ, Weissman IL. Plasticity of adult stem cells. Cell. 2004;116:639-648.
3. Tedesco FS, Cossu G. Stem cell therapies for muscle disorders. Curr Opin Neurol. 2012;25:597-603.
4. Seita J, Weissman IL. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip Rev Syst Biol Med. 2010;2:640-653.
5. Claudinot S, Nicolas M, Oshima H, et al. Long-term renewal of hair follicles from clonogenic multipotent stem cells. Proc Natl Acad Sci U S A. 2005;102:14677-14682.
6. Blanpain C, Horsley V, Fuchs E. Epithelial Stem Cells: Turning over New Leaves. Cell. 2007;128:445-458.
7. Jungebluth P, Alici E, Baiguera S, et al. Tracheobronchial transplantation with a stem-cell-seeded bioartificial nanocomposite: a proof-of-concept study. Lancet. 2011;378:1997-2004.
8. Bianco P, Cao X, Frenette PS, et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nat Med. 2013;19:35-42.
9. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 1975;6:331-343.
10. Green H, Kehinde O, Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proc Natl Acad Sci U S A. 1979;76:5665-5668.
11. Gallico GG, 3rd, O’Connor NE, Compton CC, et al. Permanent coverage of large burn wounds with autologous cultured human epithelium. N Engl J Med. 1984;311:448-451.
12. De Luca M, Albanese E, Bondanza S, et al. Multicentre experience in the treatment of burns with autologous and allogenic cultured epithelium, fresh or preserved in a frozen state. Burns. 1989;15:303-309.
13. Pellegrini G, Ranno R, Stracuzzi G, et al. The control of epidermal stem cells (holoclones) in the treatment of massive full-thickness burns with autologous keratinocytes cultured on fibrin. Transplantation. 1999;68:868-879.
14. Ronfard V, Rives JM, Neveux Y, et al. Long-term regeneration of human epidermis on third degree burns transplanted with autologous cultured epithelium grown on a fibrin matrix. Transplantation. 2000;70:1588-1598.
15. Mavilio F, Pellegrini G, Ferrari S, et al. Correction of junctional epidermolysis bullosa by transplantation of genetically modified epidermal stem cells. Nat Med. 2006;12:1397-1402.
16. Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis of stem cells and their differentiated progeny in the human ocular surface. J Cell Biol. 1999;145:769-782.
17. Schwab IR. Cultured corneal epithelia for ocular surface disease. Trans Am Ophthalmol Soc. 1999;97:891-986.
18. Tsai RJ, Li L, Chen J. Reconstruction of damaged corneas by transplantation of autologous limbal epithelial cells(1). Am J Ophthalmol. 2000;130:543.
19. Rama P, Bonini S, Lambiase A, et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of patients with total limbal stem cell deficiency. Transplantation. 2001;72:1478-1485.
20. Rama P, Matuska S, Paganoni G, et al. Limbal stem-cell therapy and long-term corneal regeneration. N Engl J Med. 2010;363:147-155.
21. Dua HS, Shanmuganathan VA, Powell-Richards AO, et al. Limbal epithelial crypts: a novel anatomical structure and a putative limbal stem cell niche. Br J Ophthalmol. 2005;89:529-532.
22. Cotsarelis G, Cheng SZ, Dong G, et al. Existence of slow-cycling limbal epithelial basal cells that can be preferentially stimulated to proliferate: implications on epithelial stem cells. Cell. 1989;57:201-209.
23. Di Iorio E, Barbaro V, Ruzza A, et al. Isoforms of DeltaNp63 and the migration of ocular limbal cells in human corneal regeneration. Proc Natl Acad Sci U S A. 2005;102:9523-9528.
24. Priya CG, Prasad T, Prajna NV, et al. Identification of Human Corneal Epithelial Stem Cells on the Basis of High ABCG2 Expression Combined With a LargeN/C Ratio. Microsc Res Tech.76:242-248.
25. Kubota M, Shimmura S, Miyashita H, et al. The anti-oxidative role of ABCG2 in corneal epithelial cells. Invest Ophthalmol Vis Sci.51:5617-5622.
26. Meyer-Blazejewska EA, Kruse FE, Bitterer K, et al. Preservation of the limbal stem cell phenotype by appropriate culture techniques. Invest Ophthalmol Vis Sci.51:765-774.
27. Santos MS, Gomes JA, Hofling-Lima AL, et al. Survival analysis of conjunctival limbal grafts and amniotic membrane transplantation in eyes with total limbal stem cell deficiency. Am J Ophthalmol. 2005;140:223-230.
28. Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet. 1997;349:990-993.
29. Li DQ, Lee SB, Tseng SC. Differential expression and regulation of TGF-beta1, TGF-beta2, TGF-beta3, TGF-betaRI, TGF-betaRII and TGF-betaRIII in cultured human corneal, limbal, and conjunctival fibroblasts. Curr Eye Res. 1999;19:154-161.
30. Li DQ, Tseng SC. Three patterns of cytokine expression potentially involved in epithelial-fibroblast interactions of human ocular surface. J Cell Physiol. 1995;163:61-79.
31. Touhami A, Grueterich M, Tseng SC. The role of NGF signaling in human limbal epithelium expanded by amniotic membrane culture. Invest Ophthalmol Vis Sci. 2002;43:987-994.
32. Dell S, Peters S, Muther P, et al. The role of PDGF receptor inhibitors and PI3-kinase signaling in the pathogenesis of corneal neovascularization. Invest Ophthalmol Vis Sci. 2006;47:1928-1937.
33. Lambiase A, Aloe L, Mantelli F, et al. Capsaicin-induced corneal sensory denervation and healing impairment are reversed by NGF treatment. Invest Ophthalmol Vis Sci. 2012;53:8280-8287.
34. Qi H, Li DQ, Shine HD, et al. Nerve growth factor and its receptor TrkA serve as potential markers for human corneal epithelial progenitor cells. Exp Eye Res. 2008;86:34-40.
35. Sakimoto T, Sawa M. Metalloproteinases in corneal diseases: degradation and processing. Cornea. 2012;31 Suppl 1:S50-56.
36. Jordan T, Hanson I, Zaletayev D, et al. The human PAX6 gene is mutated in two patients with aniridia. Nat Genet. 1992;1:328-332.
37. Mishra R, Gorlov IP, Chao LY, et al. PAX6, paired domain influences sequence recognition by the homeodomain. J Biol Chem. 2002;277:49488-49494.
38. Tohyama M, Watanabe H, Murakami S, et al. Possible involvement of CD14+ CD16+ monocyte lineage cells in the epidermal damage of Stevens-Johnson syndrome and toxic epidermal necrolysis. Br J Dermatol. 2012;166:322-330.
39. De Luca M, Pellegrini G, Green H. Regeneration of squamous epithelia from stem cells of cultured grafts. Regenerative Med. 2006;1:45-57.
40. Guerra L, Capurro S, Melchi F, et al. Treatment of “stable” vitiligo by Timedsurgery and transplantation of cultured epidermal autografts. Arch Dermatol. 2000;136:1380-1389.
41. Sangwan VS, Basu S, Vemuganti GK, et al. Clinical outcomes of xeno-free autologous cultivated limbal epithelial transplantation: a 10-year study. Br J Ophthalmol. 2011;95:1525-1529.
42. Barrandon Y, Green H. Three clonal types of keratinocyte with different capacities for multiplication. Proc Natl Acad Sci U S A. 1987;84:2302-2306.
43. Rochat A, Kobayashi K, Barrandon Y. Location of stem cells of human hair follicles by clonal analysis. Cell. 1994;76:1063-1073.
44. Shimazaki J, Higa K, Morito F, et al. Factors influencing outcomes in cultivated limbal epithelial transplantation for chronic cicatricial ocular surface disorders. Am J Ophthalmol. 2007;143:945-953.
45. Satake Y, Higa K, Tsubota K, et al. Long-term outcome of cultivated oral mucosal epithelial sheet transplantation in treatment of total limbal stem cell deficiency. Ophthalmology. 2011;118:1524-1530.
46. Shahdadfar A, Haug K, Pathak M, et al. Ex vivo expanded autologous limbal epithelial cells on amniotic membrane using a culture medium with human serum as single supplement. Exp Eye Res.97:1-9.
47. Stacey GN, Cobo F, Nieto A, et al. The development of ‘feeder’ cells for the preparation of clinical grade hES cell lines: challenges and solutions. J Biotechnol. 2006;125:583-588.
48. Liu ZZ, Chen P, Lu ZD, et al. Enrichment of breast cancer stem cells using a keratinocyte serum-free medium. Chin Med J (Engl). 2011;124:2934-2936.
49. Kormos B, Belso N, Bebes A, et al. In vitro dedifferentiation of melanocytes from adult epidermis. PLoS One. 2011;6:e17197.
50. Discher DE, Janmey P, Wang YL. Tissue cells feel and respond to the stiffness of their substrate. Science. 2005;310:1139-1143.
51. Green H. The birth of therapy with cultured cells. Bioessays. 2008;30:897-903.
52. Carrier P, Deschambeault A, Audet C, et al. Impact of cell source on human cornea reconstructed by tissue engineering. Invest Ophthalmol Vis Sci. 2009;50:2645-2652.
53. Sharma SM, Fuchsluger T, Ahmad S, et al. Comparative analysis of human-derived feeder layers with 3T3 fibroblasts for the ex vivo expansion of human limbal and oral epithelium. Stem Cell Rev. 2012;8:696-705.
54. Oie Y, Hayashi R, Takagi R, et al. A novel method of culturing human oral mucosal epithelial cell sheet using post-mitotic human dermal fibroblast feeder cells and modified keratinocyte culture medium for ocular surface reconstruction. Br J Ophthalmol. 2010;94:1244-1250.
55. Paliwal P, Sharma A, Tandon R, et al. TGFBI mutation screening and genotype-phenotype correlation in north Indian patients with corneal dystrophies. Mol Vis. 2010;16:1429-1438.
56. West MD. The cellular and molecular biology of skin aging. Arch Dermatol. 1994;130:87-95.
57. Hultman CS, Brinson GM, Siltharm S, et al. Allogeneic fibroblasts used to grow cultured epidermal autografts persist in vivo and sensitize the graft recipient for accelerated second-set rejection. J Trauma. 1996;41:51-58; discussion 58-60.
58. Halder G, Dupont S, Piccolo S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nat Rev Mol Cell Biol. 2012;13:591-600.
59. Shi ZD, Tarbell JM. Fluid flow mechanotransduction in vascular smooth muscle cells and fibroblasts. Ann Biomed Eng. 2011;39:1608-1619.
60. Weinbaum S, Guo P, You L. A new view of mechanotransduction and strain amplification in cells with microvilli and cell processes. Biorheology. 2001;38:119-142.
61. Dupont S, Morsut L, Aragona M, et al. Role of YAP/TAZ in mechanotransduction. Nature. 2011;474:179-183.
62. Zatti S, Zoso A, Serena E, et al. Micropatterning topology on soft substrates affects myoblast proliferation and differentiation. Langmuir. 2012;28:2718-2726.
63. Chowdhury F, Li Y, Poh YC, et al. Soft substrates promote homogeneous self-renewal of embryonic stem cells via downregulating cell-matrix tractions. PLoS One. 2010;5:e15655.
64. Huang C, Akaishi S, Ogawa R. Mechanosignaling pathways in cutaneous scarring. Arch Dermatol Res. 2012;304:589-597.
65. Ramselaar JA, Boot JP, van Haeringen NJ, et al. Corneal epithelial permeability after instillation of ophthalmic solutions containing local anaesthetics and preservatives. Curr Eye Res. 1988;7:947-950.
66. Burstein NL. Corneal cytotoxicity of topically applied drugs, vehicles and preservatives. Surv Ophthalmol. 1980;25:15-30.
67. Rosenwasser GO. Complications of topical ocular anesthetics. Int Ophthalmol Clin. 1989;29:153-158.
68. Bisla K, Tanelian DL. Concentration-dependent effects of lidocaine on corneal epithelial wound healing. Invest Ophthalmol Vis Sci. 1992;33:3029-3033.
69. Krejci L, Harrison R. Antiglaucoma drug effects on corneal epithelium. A comparative study in tissue culture. Arch Ophthalmol. 1970;84:766-769.
70. Qu M, Wang Y, Yang L, et al. Different cellular effects of four anti-inflammatory eye drops on human corneal epithelial cells: independent in active components. Mol Vis. 2011;17:3147-3155.
71. Nguyen DQ, Srinivasan S, Hiscott P, et al. Thimerosal-induced limbal stem cell failure: report of a case and review of the literature. Eye Contact Lens. 2007;33:196-198.
72. Zhou Y, Liu Q, Zhou T, et al. Modulation of the canonical Wnt pathway by Benzalkonium Chloride in corneal epithelium. Exp Eye Res. 2011;93:355-362.
73. Chen W, Li Z, Hu J, et al. Corneal alternations induced by topical application of benzalkonium chloride in rabbit. PLoS One. 2011;6:e26103.
74. Ye J, Wu H, Zhang H, et al. Role of benzalkonium chloride in DNA strand breaks in human corneal epithelial cells. Graefes Arch Clin Exp Ophthalmol. 2011;249:1681-1687.
75. Mason C, Dunnill P. Translational regenerative medicine research: essential to discovery and outcome. Regen Med. 2007;2:227-229.
Dr. Carmelo Chines
Direttore responsabile






