Le strie angioidi rappresentano delle soluzioni di continuo o delle deiscenze della membrana di Bruch, che si presenta ispessita, calcifica e abnormemente fragile.
La prima descrizione delle strie risale al 1889 quanto Doine descrisse tale aspetto del fundus oculi in un paziente che presentava una emorragia retinica post-traumatica. Il termine “angioidi” fu invece coniato da Knapp che ipotizzò una origine vascolare della patologia. Più tardi Kofler nel 1917 intuì che le strie angioidi avessero poco a che fare con i vasi, ma fossero altresì delle alterazioni a carico della membrana di Bruch. Ulteriori osservazioni cliniche, corroborate da dati istopatologici pubblicati alla fine degli anni ‘30, confermarono la sostanziale correttezza di tale ipotesi.
Epidemiologia e patogenesi
Sebbene le strie angioidi (SA) non sono mai state osservate alla nascita, esse sono state documentate nell’infanzia. Esse rappresentano delle soluzioni di continuo o delle deiscenze della membrana di Bruch, che si presenta ispessita, calcifica e abnormemente fragile.
È stato ipotizzato che le strie possano essere la conseguenza di traumi anche di lieve entità o che esse siano in relazione alle linee di forza trasmesse dai muscoli oculari a livello del NO. Sembra più probabile che esse si producano in modo spontaneo per una primitiva alterazione metabolica che coinvolge le fibre elastiche della membrana di Bruch. Peraltro i meccanismi patogenetici che provocano tali alterazioni sono poco chiari. La prevalenza delle SA non è nota; non ci sono differenze dell’incidenza in relazione alla razza o al sesso.
Aspetto Oftalmoscopico
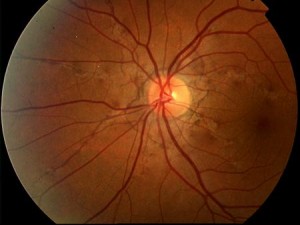
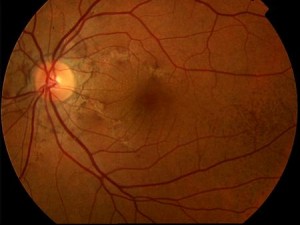
Le SA si manifestano come linee sottili e frastagliate di colore bruno-rossastro che si irradiano dal nervo ottico e che simulano il decorso di vasi sottoretinici (Figg. 1-2).
Le strie sono normalmente bilaterali anche se l’asimmetria fra i due occhi è la regola. Oltre al più frequente pattern radiale talora le SA assumono l’aspetto di anelli circolari incompleti ed irregolari peripapillari. Più raramente possono assumere una disposizione casuale al polo posteriore. Sono sempre separate dal disco ottico e si possono estendere molto anteriormente. Osservazioni seriate hanno evidenziato che le SA si estendono con il tempo. Il colore delle SA è determinato sia dalla pigmentazione del fondo che dal grado di atrofia del EPR sovrastante le lesioni. Ai margini delle strie si evidenziano spesso alterazioni pigmentarie dell’EPR, caratterizzate da accumuli focali. Il fundus può essere caratterizzato da una alterazione pigmentaria diffusa, spesso localizzata temporalmente alla macula, definita “a buccia d’arancia”. Tale alterazione sarebbe più frequente, ma non esclusiva, nei pazienti portatori di Pseudoxantoma Elastico (PXE).
In circa il 25% dei pazienti con SA si associano drusen della papilla evidenziabili oftalmoscopicamente o ecograficamente.
Diagnosi
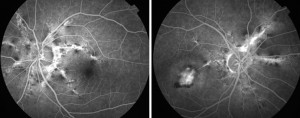
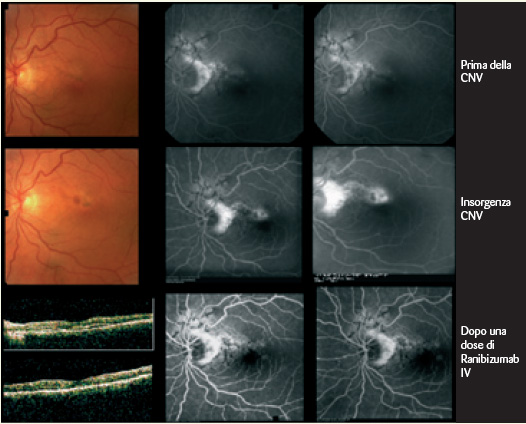
La diagnosi di SA è spesso ovvia e solo raramente è necessario il conforto di un esame fluorangiografico (FA), in quanto le lesioni possono essere oftalmoscopicamente appena percettibili. Alla FA le strie sono variamente iperfluorescenti (per trasmissione) in relazione allo stato dell’EPR sopra le lesioni. Ai margini delle strie si possono evidenziare accumuli di pigmento con conseguente ipofluorescenza da effetto maschera. Se si associa una CNV l’aspetto angiografico è generalmente quello di una membrana classica anche se sono state descritte membrane occulte alla FA (Figg. 3-4).
Diagnosi differenziale
La diagnosi differenziale deve essere posta con le patologie riportate in tabella e non pone normalmente particolari difficoltà.
TABELLA
– Rotture della Coroide
– Lacquer cracks
– Degenerazione Miopica
– CNV in degenerazione maculare senile
Associazioni sistemiche
Le patologie sistemiche associate a SA sono riportate in tabella; per sintesi tratteremo solamente dell’associazione più frequente (Pseudoxantoma Elastico) rimandando alla letteratura per l’approfondimento delle altre patologie sistemiche.
– Pseudoxantoma Elastico (PXE)
– Morbo di Paget
– Ehlers- Danlos Syndrom (Tipo 6)
– Emoglobinopatie
La più comune patologia sistemica associate alle SA è lo PXE . In una delle maggiori casistiche circa il 50% dei pazienti con SA era portatore di PXE. Lo PXE è una patologia genetica caratterizzata dalla progressiva calcificazione e frammentazione delle fibre elastiche del tessuto connettivo che interessa oltre alla cute ed alla coriocapillare, l’apparato cardiovascolare, digerente e quello uro-genitale. La malattia è trasmessa in modo sia autosomico dominante che recessivo; non esistono predilezioni di sesso o di razza. Le caratteristiche alterazioni del tessuto cutaneo e sottocutaneo sono più spesso evidenti a livello del collo, delle ascelle, dell’inguine e dell’area periombelicale (pelle a buccia d’arancia). Tipicamente le lesioni cutanee iniziano nell’infanzia, ma essendo asintomatiche vengono riconosciute solo nell’adolescenza. Le principali manifestazioni sistemiche dello PXE si evidenziano a carico della corioretina (strie + CNV), dell’apparato digerente (emorragie) e cardiovascolare (valvulopatie) e del tratto genito urinario (ematuria – ematospermia).
La fisiopatologia della malattia è caratterizzata da un disordine primitivo del tessuto elastico geneticamente determinato, evidenziato a livello cutaneo nella sezione istologica. La colorazione con ematossilina-eosina evidenzia la caratteristica “basofilia” delle fibre elastiche determinata dalla deposizione di calcio. Nel derma intermedio e profondo le fibre elastiche appaiono frammentate, rigonfie ed ammassate. Simili alterazioni si notano nella tunica media e nell’intima dei vasi sanguigni ed a livello della membrana di Bruch.
L’angiografia con verde di indocianina (ICGA), in quanto in grado di superare il filtro dell’EPR, evidenzia che le strie iperfluorescenti sono più larghe e numerose di quelle evidenziate con la FA. L’ICGA definisce meglio la presenza di CNV in caso di fluorescenza bloccata alla FA.
Terapia
La prognosi delle SA è sempre riservata e la funzione visiva centrale risulterà gravemente compromessa in almeno il 70% dei pazienti. Ciò avviene non solo per la insorgenza di una CNV, ma anche per rottura della coroide causata da trauma anche lieve o dall’estensione delle strie a coinvolgere direttamente la fovea.
I pazienti portatori di SA devono quindi essere istruiti ad evitare attività potenzialmente traumatiche per il pericolo dell’insorgenza di una emorragia retinica o di rottura della coroide.
La terapia della CNV associata a SA ha sempre rappresentato una particolare sfida per gli Oftalmologi, data la prognosi infausta della patologia.
Le opzioni terapeutiche, che si sono modificate parallelamente a quelle della CNV associata a AMD, sono:
– Trattamento laser diretto delle forme extrafoveali
– Terapia fotodinamica con verteporfina
– Terapia fotodinamica associata a triamcinolone IV
– Iniezione IV di inibitori del VEGF
L’efficacia della fotocoagulazione laser non è mai stata verificata in studi clinici controllati. Ci sono evidenze sporadiche che il trattamento di forme extra o juxta foveali possa essere di qualche efficacia. Singerman and Hatem hanno riportato buoni risultati a lungo termine in sette pazienti su otto. La più ampia esperienza sul trattamento fotocoagulativo è riportata da Pece e coll. che hanno stabilizzato l’acutezza visiva in una serie di 66 occhi di 52 pazienti con CNV classica extrafoveale. Il limite di tale procedura terapeutica consiste ovviamente nella impossibilità di trattare le forme subfoveali e nell’altissima percentuale di recidive stimate intorno al 77%. Peraltro l’evoluzione naturale della CNV in pazienti con SA sembrerebbe particolarmente grave, come riportato in una breve casistica di Lim et al. che in un gruppo di 11 pazienti non trattati hanno rilevato in tutti un visus finale pari a conta dita.
Sono stati, inoltre, fatti infruttuosi tentativi di rallentare la progressione delle strie verso la fovea mediante fotocoagulazione laser profilattica che, oltre ad essere inutile, può di per sé stimolare la formazione di una CNV.
La terapia fotodinamica con Verteporfina (PDT-V)
Come per il trattamento laser diretto non esistono studi clinici controllati che abbiano verificato la sicurezza e l’efficacia della PDT-V in pazienti con CNV secondarie a SA. Il trattamento fotodinamico rappresenta, quindi, una estensione razionale, ma arbitraria fatta per analogia con il trattamento della forma senile e miopica di CNV.
Le informazioni disponibili in letteratura sono scarne e contraddittorie. Si tratta di piccole serie di casi in cui si alternano risultati incoraggianti, consistenti nella stabilizzazione della patologia, e risultati meno buoni, caratterizzati dalla progressione della lesione e dalla riduzione progressiva della acutezza visiva. La maggior casistica prodotta in letteratura è quella di Menchini, che ha cumulato i risultati ottenuti in 6 centri italiani su 48 occhi, evidenziando una progressiva estensione della CNV in oltre il 60% dei pazienti trattati ed una riduzione della acutezza visiva in circa il 50% dei pazienti.
Altre limitate serie hanno riportato risultati sostanzialmente analoghi e dall’esame complessivo di tali casistiche emerge il concetto che la PDT non sembra essere un buon trattamento per le CNV associate a strie in quanto, i vantaggi sono transitori le recidive sono frequenti e la prognosi a lungo termine non sembra influenzata dalla terapia.
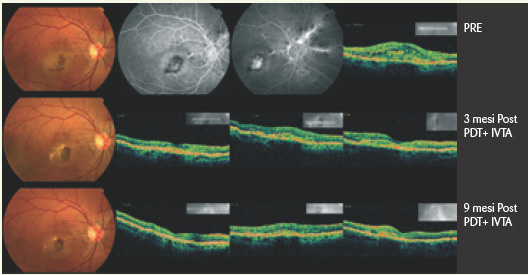
Anche l’associazione della PDT-V con iniezione intravitreale di triamcinolone ha dato effetti controversi, data l’alternanza di risultati sorprendenti (Fig. 5) ed altri meno incoraggianti.
Inibitori del VEGF
La recente introduzione degli inibitori del VEGF nella terapia della CNV apre nuovi orizzonti nella terapia della forma associata a SA. Sono recentemente comparsi in letteratura alcuni lavori su piccole casistiche che suggeriscono l’efficacia degli inibitori del VEGF in tale patologia. Tali iniziali incoraggianti risultati dovranno essere verificati nel tempo, data la particolare tendenza della CNV associata a SA alla progressione ed alla recidiva. Osservazioni episodiche personali sembrano comunque confermare la possibilità di ottenere, perlomeno a breve scadenza, buoni risultati (6).
Federico Ricci
UOSD Patologie Retiniche
Fondazione Policlinico
Tor Vergata, Roma
Bibliografia
1. Mansour AM, Shields JA, Annesley WH Jr, et al. Macular degeneration in angioid streaks. Ophthalmologica 1988;197:36-41.
2. Clarkson JG, Altman RD. Angioid streaks. Surv Ophthalmol 1982;26:235-46.
3. Singerman LJ, Hatem G. Laser treatment of choroidal neovascular membranes in angioid streaks. Retina 1981;1:75-83.
4. Pece A, Avanza P, Galli L, Brancato R. Laser photocoagulation of choroidal neovascularization in angioid streaks. Retina 1997;17:12-16.
5. Menchini U, Virgili G, Introini U, et al. Outcome of choroidal neovascularization in angioid streaks after photodynamic therapy. Retina 2004;24(5):763-771.
6. Marco Zarbin. Should corticosteroids be considered as part of the standard care with photodynamic therapy? Am J Ophthalmol 2006;124:563-571.
7. Spaide R, Sorenson J, Maranan L. Combined photodynamic therapy with verteporfin and intravitreal triamcinolone acetonide for choroidal neovascularization. Ophthalmology 2003;110:1517-1525.
8. Ciulla TA, Criswell MH, Danis RP, Hill TE. Intravitreal triamcinolone acetonide inhibits choroidal neovascularization in a laser-treated rat model. Arch Ophthalmol 2001;119:399–404.
9. Gillies MC, Simpson JM, Luo W, et al. A randomized clinical trial of a single dose of intravitreal triamcinolone acetonide for neovascular age-related macular degeneration: one-year results. Arch Ophthalmol 2003;121:667–673.
10. Spaide RF, Sorenson J, Maranan L. Photodynamic therapy with verteporfin combined with intravitreal injection of triamcinolone acetonide for choroidal neovascularization. Ophthalmology 2005;112:301–304.
11. Arias L,Garcia-Arumi J, Ramon J.M., et al. Photodynamic Therapy with Intravitreal Triamcinolone in Predominantly Classic Choroidal Neovascularization. One-Year Results of a Randomized Study Ophthalmology 2005;112(7):1227-1231.
12. Kaiser P.K. Verteporfin therapy in combination with triamcinolone: published studies investigating a potential synergistic effect. Curr Med Res Opin 2005;21(5):705-713.
13. Sandowski T, Steinmeyer J. Effects of polysulfated glycosaminoglycan and triamcinolone acetonid on the production of proteinases and their inhibitors by IL-1alpha treated articular chondrocytes. Biochem Pharmacol 2002;15;64(2):217-227.
14. Wang YS, Friedrichs U, Eicler W, et al. Inhibitory effects of triamcinolone acetonide on bFGF- induced migration and tube formation in choroidal microvascular endothelial cells. Graefes Arch Clin Exp Ophthalmol 2002;240:42-48.
15. Gordon SG, Overland JF, Foley J. Evidence for increased protease activity secreted from cultured fibroblasts from patients with pseudoxanthoma elasticum. Conn Tissue Res 1978;6:61-68.
16. Schwartz, F.A. Cruickshank, M.G. Lebwohl, Elastase-like protease and elastolytic activities expressed in cultured dermal fibroblasts derived from lesional skin of patients with pseudoxanthoma elasticum, actinic elastosis, and cutis laxa. Clin Chim Acta 1988;176:219–224.
17. Quaglino D, Sartor L, Garbisa S, et al. Dermal fibroblasts from pseudoxanthoma elasticum patients have raised MMP-2 degradative potential. Biochim Biophys Acta 2005 Jun 30;1741(1-2):42-47.
18. Teixeira A, Moraes N, Farah ME, Bonomo PP. Choroidal neovascularization treated with intravitreal injection of bevacizumab (Avastin) in angioid streaks. Acta Ophthalmol Scand 2006;84(6):835-836.
Dr. Carmelo Chines
Direttore responsabile