Abbiamo intervistato sulle ultime novità in tema di infiammazione e DMLE il dott. Florian Sennlaub, Direttore dell’équipe 14: “Inflammation, dégénérescence et remodellage vasculaire” dell’Institut de la Vision di Parigi.
Esistono quindi dei nuovi target verso cui indirizzare la ricerca farmacologica?
Studi recenti suggeriscono che i mediatori dell’infiammazione giocano un ruolo importante nella fisiopatologia della DMLE. È stato dimostrato che le drusen (depositi biancastri sottoretinici) contengono delle molecole del sistema immunitario quali i complessi immuni, i fattori del complemento, il Complesso Maggiore di Istocompatibilità (CMI) e degli oligomeri di amiloide. D’altronde la DMLE è associata a un polimorfismo che attenua la funzione del fattore H e con la perdita dell’attività inibitrice del fattore H, il sistema del complemento risulta iperattivo nel corso della DMLE. Resta tuttavia poco chiaro come la iperattivazione del complemento concorra alla patogenesi della DMLE.
Le cellule microgliali, macrofagi residenti nel sistema nervoso centrale, sono localizzate nella retina interna [1] e normalmente sono assenti dallo strato dei fotorecettori e dallo spazio sottoretinico situato tra l’epitelio pigmentato retinico (EPR) e la retina. Nella DMLE, i macrofagi si attivano e si accumulano [2, 3] nello spazio sottoretinico [1, 4]. Questo accumulo è stato interpretato come effetto secondario. I macrofagi verrebbero reclutati per ripulire lo strato dei fotorecettori dalle cellule morte.
[caption id="attachment_759" align="aligncenter" width="267" class=" "]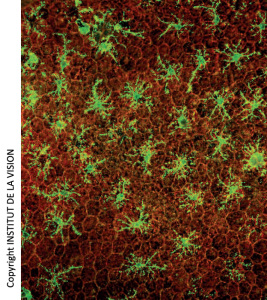 Macrofagi sottoretinici su montaggi orizzontali di Epitelio Pigmentato Retinico (EPR). In rosso, le cellule dell’EPR (a nido d’ape). In verde i macrofagi.[/caption]
Macrofagi sottoretinici su montaggi orizzontali di Epitelio Pigmentato Retinico (EPR). In rosso, le cellule dell’EPR (a nido d’ape). In verde i macrofagi.[/caption]
Nel corso dell’ultimo decennio, numerosi studi si sono occupati del ruolo delle chemochine, piccole proteine secrete che reclutano i macrofagi nelle malattie infiammatorie. Le chemochine CCL2 e CX3CL1 svolgono un ruolo chiave nel reclutamento e nell’attivazione di monociti, macrofagi e cellule microgliali [5, 6].
La chemochina CCL2 viene liberata mediante lesioni tissutali e partecipa al reclutamento dei monociti infiammatori circolanti che esprimono in grande quantità il recettore CCR2. I monociti infiammatori reclutati riducono rapidamente l’espressione del CCR2 e si differenziano in macrofagi (M?) infiammatori. Il macrofago (M?) infiammatorio secerne un certo numero di fattori battericidi che possono anche avere un effetto neurotossico. In seguito i M? acquisiscono un fenotipo meno aggressivo che favorisce l’angiogenesi e la cicatrizzazione, prima di scomparire o di permanere per lungo tempo nel tessuto come macrofago tissutale.
CX3CL1 è una chemochina atipica: è una proteina di transmembrana con una funzione assimilabile alle integrine. Nell’occhio è espressa in forma costitutiva dai neuroni della retina e dell’EPR. Il suo recettore, il CX3CR1, è espresso in grande quantità dalle cellule microgliali [1, 7].
Il segnale CX3CL1/CX3CR1 induce un fenotipo di supporto nelle Cellule Microgliali (MCs). Il CX3CL1, sfaldato dalla membrana dalle proteasi in una forma solubile, può sviluppare delle proprietà chemiotattiche [8].
Un macrofago pienamente differenziato, ma derivato da un monocita infiltrante può diventare molto simile ad una cellula microgliale, presente nella retina dopo lo sviluppo fetale, sia per la sua morfologia che per le proteine che esprime.
Questi studi hanno delle ricadute sulla patogenesi della DMLE?
Alcuni anni fa abbiamo osservato con grande sorpresa che i topi privi del gene Cx3cr1 (topi Cx3cr1-/) presentano un accumulo spontaneo età-dipendente di cellule infiammatorie (M? o MCs) nello spazio sottoretinico. Questo accumulo si verifica in assenza di una degenerazione iniziale dei fotorecettori o dell’EPR [1]. I risultati contrastano fortemente col comportamento dei M? nel tessuto periferico infiammatorio che presenta un deficit di accumulo nelle zone della lesione in seguito alla assenza del Cx3cr1 [6].
[caption id="attachment_760" align="aligncenter" width="143" class=" "]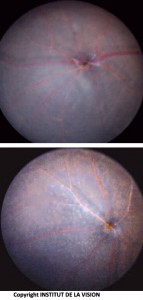 Fondo dell’occhio di topo knock out e controllo. I macrofagi sottoretinici (topo KO) sono visibili come piccoli punti bianchi.[/caption]
Fondo dell’occhio di topo knock out e controllo. I macrofagi sottoretinici (topo KO) sono visibili come piccoli punti bianchi.[/caption]
Nei topi Cx3cr1-/-, la presenza prolungata di M?/MCs nello spazio sottoretinico è associata a una fagocitosi eccessiva dei segmenti esterni dei fotorecettori da parte di M?/MCs, il che comporta l’accumulo di lipidi intracellulari [9, 1].
Quali in sintesi gli obiettivi e i potenziali sviluppi terapeutici delle attività condotte dal vostro gruppo di ricerca?
Le ricerche svolte nel nostro laboratorio tentano di identificare i meccanismi di reclutamento dei macrofagi nello spazio sottoretinico, i fattori che favoriscono la loro sopravvivenza e quindi il loro accumulo, nonché i fattori neurotossici e angiogenici secreti dalle cellule infiammatorie.
Questo concetto innovatore ci consentirà di sviluppare delle nuove terapie farmacologiche che mirano a impedire l’accumulo dei macrofagi e/o dei loro fattori patogeni. Nell’animale, questi trattamenti sono in grado di impedire sia la degenerazione dei fotorecettori che la neovascolarizzazione. Nell’uomo, in un futuro relativamente prossimo, potrebbero costituire un nuovo trattamento terapeutico per le forme atrofiche e umide della DMLE.
Bibliografia
1) Combadiere C, Feumi C, Raoul W, Keller N, Rodero M, Pezard A, Lavalette S, Houssier M, Jonet L, Picard E, Debre P, Sirinyan M, Deterre P, Ferroukhi T, Cohen SY, Chauvaud D, Jeanny JC, Chemtob S, Behar-Cohen F, Sennlaub F (2007) CX3CR1-dependent subretinal microglia cell accumulation is associated with cardinal features of age-related macular degeneration. J Clin Invest 117:2920-2928.
2) Penfold PL, Liew SC, Madigan MC, Provis JM (1997) Modulation of major histocompatibility complex class II expression in retinas with age-related macular degeneration. Invest Ophthalmol Vis Sci 38:2125-2133.
3) van der Schaft TL, Mooy CM, de Bruijn WC, de Jong PT (1993) Early stages of age-related macular degeneration: an immunofluorescence and electron microscopy study. Br J Ophthalmol 77:657-661.
4) Gupta N, Brown KE, Milam AH (2003) Activated microglia in human retinitis pigmentosa, late-onset retinal degeneration, and age-related macular degeneration. Exp Eye Res 76:463-471.
5) Combadiere C, Potteaux S, Rodero M, Simon T, Pezard A, Esposito B, Merval R, Proudfoot A, Tedgui A, Mallat Z (2008) Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6C(hi) and Ly6C(lo) monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice. Circulation 117:1649-1657.
6) Combadiere C, Potteaux S, Gao JL, Esposito B, Casanova S, Lee EJ, Debre P, Tedgui A, Murphy PM, Mallat Z (2003) Decreased atherosclerotic lesion formation in CX3CR1/apolipoprotein E double knockout mice. Circulation 107:1009-1016.
7) Checchin D, Sennlaub F, Levavasseur E, Leduc M, Chemtob S (2006) Potential role of microglia in retinal blood vessel formation. Invest Ophthalmol Vis Sci 47:3595-3602.
8) Ransohoff RM (2009) Chemokines and chemokine receptors: standing at the crossroads of immunobiology and neurobiology. Immunity 31:711-721.
9) Raoul W, Feumi C, Keller N, Lavalette S, Houssier M, Behar-Cohen F, Combadiere C, Sennlaub F (2008) Lipid-bloated subretinal microglial cells are at the origin of drusen appearance in CX3CR1-deficient mice. Ophthalmic Res 40:115-119.
10) Zweifel SA, Imamura Y, Spaide TC, Fujiwara T, Spaide RF (2010) Prevalence and Significance of Subretinal Drusenoid Deposits (Reticular Pseudodrusen) in Age-Related Macular Degeneration. Ophthalmology.
11) Rudolf M, Malek G, Messinger JD, Clark ME, Wang L, Curcio CA (2008) Sub-retinal drusenoid deposits in human retina: organization and composition. Exp Eye Res 87:402-408.
12) Cohen SY, Dubois L, Tadayoni R, Delahaye-Mazza C, Debibie C, Quentel G (2007) Prevalence of reticular pseudodrusen in age-related macular degeneration with newly diagnosed choroidal neovascularisation. Br J Ophthalmol 91:354-359.
13) Raoul W, Keller N, Rodero M, Behar-Cohen F, Sennlaub F, Combadiere C (2008) Role of the chemokine receptor CX3CR1 in the mobilization of phagocytic retinal microglial cells. J Neuroimmunol 198:56-61.
14) Ma W, Zhao L, Fontainhas AM, Fariss RN, Wong WT (2009) Microglia in the mouse retina alter the structure and function of retinal pigmented epithelial cells: a potential cellular interaction relevant to AMD. PLoS One 4:e7945.
15) Roque RS, Rosales AA, Jingjing L, Agarwal N, Al-Ubaidi MR (1999) Retina-derived microglial cells induce photoreceptor cell death in vitro. Brain Res 836:110-119.
16) Nakazawa T, Hisatomi T, Nakazawa C, Noda K, Maruyama K, She H, Matsubara A, Miyahara S, Nakao S, Yin Y, Benowitz L, Hafezi-Moghadam A, Miller JW (2007) Monocyte chemoattractant protein 1 mediates retinal detachment-induced photoreceptor apoptosis. Proc Natl Acad Sci U S A 104:2425-2430.
Per saperne di più contatta:
Florian Sennlaub
Institut de la Vision
17, rue Moreau
75012 Paris – France
E.mail: Florian.sennlaub[at]inserm.fr
Web site: www.institut-vision.org
Dr. Carmelo Chines
Direttore responsabile


