Il crescente impiego di farmaci antiglaucomatosi attivi sulle vie uveo-sclerali (prevalentemente prostaglandine e prostanoidi), ha negli ultimi anni rinnovato l’interesse nello studio fisiopatologico di tali vie di deflusso.
Come noto, la maggior parte dell’umore acqueo prodotto viene drenato mediante un percorso pressione dipendente, a livello del trabecolato; si stima che circa il 70-80 % dei fluidi intra-oculari venga eliminato, in condizioni fisiologiche, mediante tale via. Il rimanente 20-30% segue invece un percorso alternativo, pressione indipendente, raggiungendo la sovracoroide dopo aver permeato la matrice extracellulare del corpo ciliare. Una volta giunto nello spazio sovra-coroideale una quota (la maggiore) di umore acqueo rientra nel circolo per riassorbimento da parte della coriocapillare mediante gradienti pressori di tipo colloido-osmotico. Una parte non trascurabile di fluidi riesce, però, a permeare la sclera ed a fuoriuscire dal bulbo oculare percorrendo gli spazi perineurali e perivascolari dell’episclera e quindi i tessuti adiposi extra-orbitari2. Lo spazio sovra-coroideale assume, dunque, in tale percorso una posizione intermedia poiché, in definitiva, l’umore acqueo defluisce attraverso il muscolo ciliare e quindi successivamente permea la sclera dalla sovracoroide. Nella maggior parte delle strutture dell’organismo i fluidi intra-tissutali extra-vascolari vengono riassorbiti mediante il sistema vascolare linfatico; l’assenza di tale rete capillare spiega il perché nella sclera si attivino invece vie alternative di drenaggio.
Recenti studi
3 condotti su occhi di topo hanno sperimentalmente verificato tali acquisizioni, studiando i percorsi dell’acqueo mediante l’introduzione intra-camerulare di traccianti fluorescenti (destrano 70-KDa): a partire dai 60’ seguenti l’infusione, si possono chiaramente apprezzare segni di filtrazione trans-sclerale. Da quanto esposto si evince come la sclera possieda in definitiva una propria conduttività idraulica (intesa come capacità nel lasciarsi attraversare da fluidi) fondamentale nel garantire il completamento dell’outflow trans-sclerale e clinicamente rilevante per i risvolti che può avere sulla regolazione della PIO (pressione intra-oculare) e dei processi di assorbimento ed eliminazione di farmaci. In riferimento a quest’ultimo aspetto, si può facilmente comprendere come l’esistenza di un flusso di liquidi diretto dall’interno all’esterno che attraversi la sclera, possa ostacolare l’assorbimento di farmaci instillati localmente, oppure mediante iontoforesi, pompe osmotiche ed iniezioni peri-oculari
4,5. Diversamente, invece, tale fenomeno sembrerebbe favorire l’eliminazione di farmaci presenti all’interno del bulbo oculare. La conduttività idraulica sclerale è influenzata da vari parametri, i più importanti dei quali sono rappresentati dall’età e dallo spessore tissutale: generalmente si osserva un rapporto di proporzionalità inversa con il primo e diretta con il secondo per cui più la sclera è giovane e spessa, minore resistenza oppone al passaggio di acqueo. Questo perché una sclera spessa presenterà spazi maggiori tra le lamine collagene, maggiore idratazione e quindi un minore indice di resistività idraulica. Tali aspetti sono in accordo con le osservazioni esistenti in letteratura testimonianti come il deflusso uveo-sclerale sia maggiore nei giovani, i livelli di idratazione sono più elevati nei giovani donatori e come la sclera sia maggiormente compliante nelle chirurgie effettuate su occhi di bambini. Tuttavia, inaspettatamente, la conduttività idraulica non presenta variazioni topografiche, come sarebbe lecito aspettarsi in conseguenza del diverso spessore sclerale tra la porzione anteriore, equatoriale e posteriore
6.Partendo da tali basi teoriche ben si comprende come un’accurata conoscenza ed analisi delle capacità idro-conduttive della sclera possa fornire nuovi approcci per gestire la pressione intra-oculare nei pazienti affetti da ipertensione oculare o da glaucoma.
Importanza del deflusso trans-sclerale nell’ipertensione oculare e nel glaucoma
Cosa accade al deflusso trans-sclerale nei pazienti affetti da ipertensione oculare (OH) o da glaucoma primario ad angolo aperto (POAG)? Negli ultimi anni ci si è accorti della possibilità di poter studiare in vivo la filtrazione trans-sclerale di acqueo, analizzando le caratteristiche microscopiche delle bozze filtranti in pazienti sottoposti a chirurgia perforante7,8, mediante l’esecuzione di microscopia confocale della congiuntiva. Nelle bozze funzionanti (clinicamente di aspetto diffuso o cistico), la presenza di percolazione e quindi flusso di acqueo che permea prima la sclera e successivamente gli strati congiuntivali, è testimoniata dal riscontro di strutture microcistiche intra-epiteliali (Fig. 1).
[caption id="attachment_1892" align="alignleft" width="150"]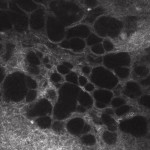 Ph 1: Bozza congiuntivale funzionante: evidenza di numerose microcisti epiteliali, in parte confluenti[/caption]
Ph 1: Bozza congiuntivale funzionante: evidenza di numerose microcisti epiteliali, in parte confluenti[/caption]
Diversamente, nelle bozze non funzionanti (clinicamente incapsulate o piatte), si osservano scarse o nessuna microcisti a testimoniare l’ostacolo meccanico alla percolazione fornito dalla fibrosi sottocongiuntivale. Tali strutture cistiche rappresentano in definitiva, un segno in vivo del passaggio trans-sclerale di fluidi. Recentemente, tuttavia, studiando la congiuntiva di pazienti ipertesi oculari e di pazienti glaucomatosi candidati a chirurgia, si è riscontrata la presenza delle stesse strutture microcistiche descritte nelle bozze funzionanti, seppur con morfologia leggermente diversa. Scopo dello studio9 è stato quello di valutare e descrivere in vivo, mediante l’ausilio della microscopia confocale, l’esistenza e le caratteristiche del deflusso trans-sclerale in pazienti ipertesi oculari non trattati ed in pazienti glaucomatosi in terapia medica.
Caratteristiche e risultati dello studio
Nello studio sono stati arruolati 30 occhi affetti da OH non in terapia farmacologica (PIO: 24.1± 1.83 mmHg) e 96 occhi affetti da POAG in compenso farmacologico (PIO: 16.4±2.01mmHg) (28 assumevano ?-bloccanti in monoterapia, Gruppo 1; 46 prostaglandine/prostamidi in monoterapia, Gruppo 2; 22 erano in terapia combinata non fissa prostaglandine/prostamidi + ?-bloccanti, Gruppo 3); un gruppo di 15 consecutivi occhi sani (PIO: 14.3±1.6 mmHg) è stato utilizzato come controllo. Tutti i pazienti sono stati sottoposti ad esame della congiuntiva bulbare superiore e temporale mediante microscopia confocale in vivo (LSM; HRT II Cornea Module; Heidelberg Engineering GmbH, Heidelberg, Germany).
[caption id="attachment_1893" align="alignleft" width="150"]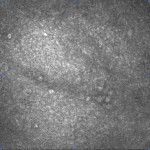 Ph 2: Occhio di controllo: non si apprezzano microcisti nell’epitelio congiuntivale[/caption]
Ph 2: Occhio di controllo: non si apprezzano microcisti nell’epitelio congiuntivale[/caption]
I parametri considerati sono stati due: la densità media (cisti/mm2) e la superficie totale delle microcisti (µm2), quest’ultima calcolata tramite l’ausilio di ImageJ, un software open source disponibile on-line (http://rsb.info.nih. gov/ij/).
I risultati ottenuti e le caratteristiche dei gruppi sono riportati nella tabella 1.
Come è possibile evidenziare dai dati, le strutture microcistiche sono assenti negli occhi normali (Fig. 2), mentre sono evidenziabili in tutti gli occhi ipertesi (Fig. 3) e glaucomatosi (Fig. 4), senza differenze significative tra OH e POAG.
Differenze significative sono state evidenziate, invece, tra i 3 sottogruppi di pazienti glaucomatosi in terapia, rilevandosi valori di densità microcistica media maggiori nel Gruppo 3 rispetto al Gruppo 2 e valori di superficie totale media maggiori nel Gruppo 3 rispetto al Gruppo 1. (Tabella 2).
Conclusioni
Dai risultati ottenuti si possono trarre alcune importanti conclusioni che per diversi aspetti, costituiscono concetti nuovi nella fisiopatologia dell’idrodinamica oculare e della malattia glaucomatosa. La presenza infatti di microcisti congiuntivali intra-epiteliali in occhi affetti da ipertensione oculare non trattata, costituisce un chiaro segno dell’attivazione di vie alternative di deflusso in condizioni iperbariche: in presenza di PIO elevata e di verosimile saturazione delle vie canoniche di deflusso trabecolare, l’umore acqueo cerca in definitiva di abbandonare il bulbo oculare mediante vie trans-sclerali, permeando in successione la sclera e la congiuntiva. Lo stesso accade, senza differenze sostanziali, nei pazienti glaucomatosi in terapia testimoniando questo come il deflusso trans-sclerale si attivi molto precocemente nel processo.
Analizzando il fattore pressione oculare, vista l’assenza di correlazione significativa tra PIO e densità-area delle microcisti sia nei pazienti affetti da OH che da POAG, si evince come l’elemento PIO elevata costituisca un momento fondamentale nell’attivazione del processo, nonostante non ne rappresenti l’unico determinante. Tale ipotesi potrebbe infatti trovare conferma nell’evidenza che la pressione intra-oculare non appare necessaria nella spinta al mantenimento della filtrazione, vista la persistenza di deflusso trans-sclerale nonostante il controllo farmacologico della PIO nei pazienti glaucomatosi.
Sulla base delle considerazioni iniziali ed alla luce dei risultati ottenuti nel presente studio, si può in definitiva ipotizzare che in condizioni iperbariche vengono attivati meccanismi di compenso idrodinamico che sfruttano la conduttività idraulica sclerale, in virtù della quale il sistema chiuso del bulbo oculare cercherebbe di ridurre le forze interne di stress (PIO dipendenti), scaricando umore acqueo oltre la congiuntiva. Del resto sicuramente non ci troviamo di fronte ad artefatti dovuti ai principi attivi oppure ai conservanti presenti nei farmaci antiglaucomatosi, vista la presenza di strutture microcistiche anche negli ipertesi oculari non in terapia. Le differenze tra i sottogruppi di pazienti glaucomatosi in terapia farmacologica sono invece, con i dati sin’ora acquisiti, difficilmente spiegabili e vanno verificate con ulteriori studi. In conclusione, le vie di deflusso trans-sclerali dimostrate adesso anche in vivo, si mostrano fondamentali e primarie nei meccanismi di compenso cui l’occhio può attingere in condizioni iperbariche, laddove il deflusso trabecolare si presenta ridotto. La prima conseguenza è che la congiuntiva, infine definibile come il terminale di tale percorso, costituisce una nuova struttura bersaglio, facilmente accessibile alla diagnostica, dove ricercare e studiare le modificazioni indotte dalla malattia glaucomatosa. Analizzando il tutto in termini terapeutici, avere nel futuro prossimo farmaci in grado di sfruttare ed incrementare tale via di deflusso, potrebbe sicuramente consentire di gestire la PIO in modo migliore e più efficace.
Leonardo Mastropasqua,
Marco Ciancaglini,
Luca Agnifili
Clinica Oftalmologica – Centro di Eccellenza in Oftalmologia Università degli studi G. d’Annunzio Chieti-Pescara
Bibliografia
1. Weinreb RN, Toris CB, Gabelt BT, et al. Effects of prostaglandins on the aqueous humor outflow pathways. Surv Ophthalmol. 2002; 47(suppl 1):S53–S64.
2. Inomata H, Bill A. Exit sites of uveoscleral flow of aqueous humor in cynomolgus monkey eyes. Exp Eye Res. 1977;25:113–118.
3. Lindsey JD, Weinreb RN. Identification of the Mouse Uveoscleral Outflow Pathway Using Fluorescent Dextran. Invest Ophthalmol Vis Sci. 2002;43:2201–2205.
4. Myles ME, Neumann DM, Hill JM. Recent progress in ocular drug delivery for posterior segment disease: emphasis on transscleral iontophoresis. Adv Drug Deliv Rev. 2005;57:2063–2079.
5. Ambati J, Gragoudas ES, Miller JW, et al. Transscleral delivery of bioactive protein to the choroid and retina. Invest Ophthalmol Vis Sci. 2000;41:1186–1191.
6. Olsen TW, Aaberg SY, Geroski DH, Edelhauser HF. Human sclera: thickness and surface area. Am J Ophthalmol. 1998;125:237–241.
7. Labbé A, Dupas B, Hamard P, Baudouin C. In vivo confocal microscopy study of blebs after filtering surgery. Ophthalmology 2005; 112:1979.
8. Ciancaglini M, Carpineto P, Agnifili L, Nubile M, Lanzini M, Fasanella V, Mastropasqua L. Filtering Bleb Functionality: a Clinical, Anterior Segment Optical Coherence Tomography and In Vivo Confocal Microscopy Study. J Glaucoma. 2008. Jun-Jul;17(4):308-17.
9. Ciancaglini M, Carpineto P, Agnifili L, Nubile M, Fasanella V, Mastropasqua L. Conjunctival modifications in ocular hypertension and primary open angle glaucoma: an in vivo confocal microscopy study. Invest Ophthalmol Vis Sci. 2008. Jul;49(7):3042-8. Epub 2008 Mar 3.
Dr. Carmelo Chines
Direttore responsabile




