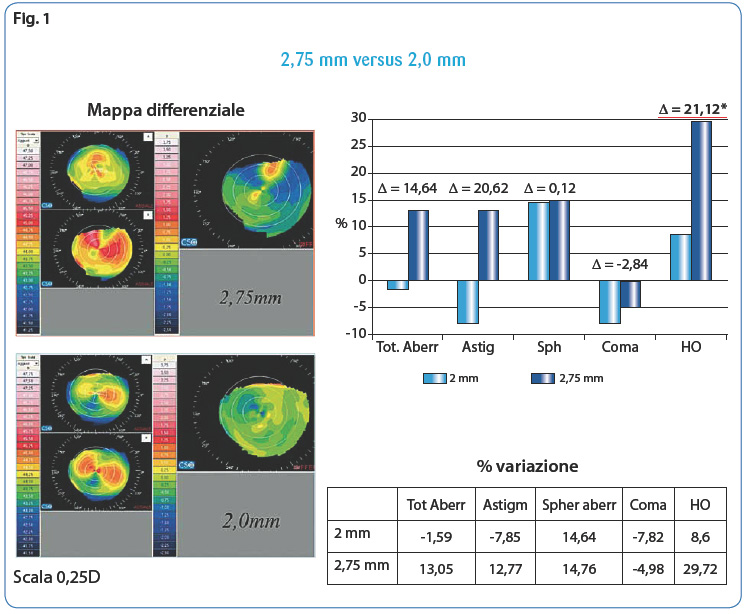
Anche per quanto riguarda gli indici rifrattivi, abbiamo dimostrato come l’indice di asimmetria (SAI) sia minore con l’incisione da 2 mm, mentre l’irregolarità di superficie sia maggiore con quella da 2,75 mm (Fig. 2).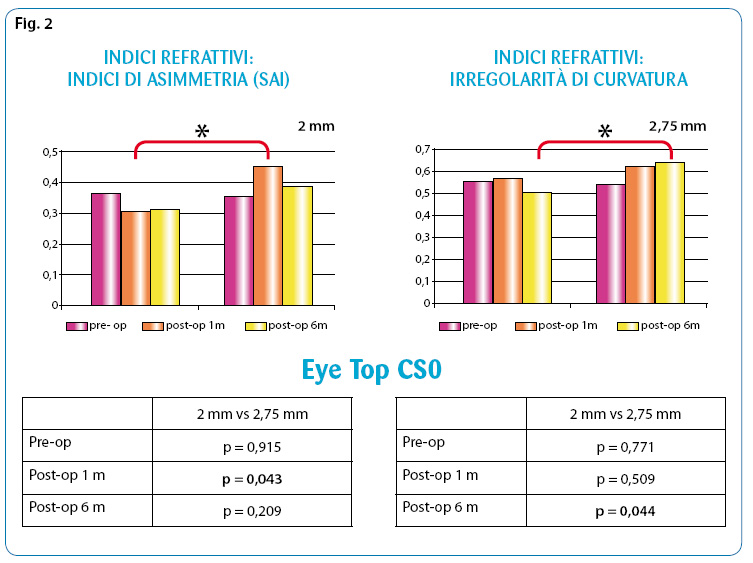
IOL e qualità della visione Per quanto riguarda il rapporto tra lente intraoculare e qualità della visione si può affermare come le IOL, in relazione alla geometria dell’ottica, variabile per la forma (equibiconvessa, pianoconvessa anteriore o posteriore), per il raggio di curvatura e per le caratteristiche del bordo (square edge o round edge), hanno manifestato risultati visivi variabili relativamente al fenomeno aberrometrico ed al glare(4). Infatti, la sola misura quantitativa dell’acuità visiva con l’ottotipo non può esprimere interamente la funzionalità visiva, ma deve essere associata alla misurazione della sensibilità al contrasto e delle aberrazioni oculari(5). La presenza di qualsiasi difetto presente nel sistema ottico, dal film lacrimale alla retina, che produca una distorsione dei raggi luminosi o un’imperfetta focalizzazione delle immagini sulla retina, genera alterazioni della visione(6). E tutto ciò vale anche nel paziente pseudofachico. Per quanto riguarda la sensibilità al contrasto, è stato dimostrato come essa si riduca fisiologicamente con l’età: questo fenomeno è dovuto all’aumento delle aberrazioni totali presenti nell’occhio(7). Inoltre quando la sensibilità al contrasto si riduce dopo l’intervento di cataratta, la qualità della visione si riduce anch’essa e di conseguenza anche la capacità di leggere o vedere durante la notte(8). È peraltro dimostrato come le performance delle IOL di nuovo design siano migliori sia in condizioni fotopiche sia mesopiche(9,10). Oltre a migliorare la sensibilità al contrasto, lo studio di IOL di nuovo design mira a ridurre le aberrazioni ottiche, anch’esse responsabili di una visione non ottimale.
Aberrazioni intraoculari e pratica clinica Nella pratica clinica, l’entità delle aberrazioni oculari viene misurata con l’aberrometro, viene espressa in micron e rappresentata in una mappa aberrometrica(11). L’utilizzo dell’aberrometro si è esplicato finora soprattutto nell’ambito della chirurgia rifrattiva corneale, come strumento diagnostico per permettere una specifica chirurgia personalizzata. Attualmente, lo studio delle aberrazioni si estende anche nell’ambito della gestione pre e postoperatoria della chirurgia della cataratta, per valutare eventuali aberrazioni indotte dai vari tipi di IOL impiantate. Nell’ambito dello studio dei pazienti pseudofachici l’aberrazione più importante è l’aberrazione sferica (Z4,0). Si tratta di un’aberrazione simmetrica per cui i raggi di luce che passano nella zona parassiale (centrali) della pupilla vanno a fuoco ad una distanza diversa rispetto a quelli che passano attraverso la pupilla marginale (laterali). Per convenzione, l’aberrazione sferica è positiva quando i raggi marginali vanno a fuoco prima di quelli parassiali, mentre è negativa quando avviene il contrario. La differenza fra il punto focale marginale e quello parassiale è detta aberrazione sferica longitudinale(12). Lo studio delle aberrazioni ottiche ha indotto alla costruzione di IOL di nuova generazione asferiche. Il cristallino di un soggetto giovane presenta un’aberrazione sferica negativa, perché il proprio indice di refrazione è più basso nella periferia rispetto a quello vicino all’asse visivo. A partire dai 40 anni di età, il cristallino presenta delle modificazioni aberrometriche importanti che con il passare degli anni passano da un valore negativo ad uno positivo(13). D’altra parte, la cornea è una superficie normalmente prolata, ossia presenta un potere rifrattivo inferiore in periferia rispetto alla zona centrale, responsabile della formazione di aberrazioni sferiche positive. Contrariamente al cristallino, la cornea è un sistema ottico che rimane relativamente stabile con il passare degli anni per cui la propria aberrazione sferica positiva non si modifica. Quindi, il cristallino fisiologicamente non solo perde la capacità di compensare le aberrazioni corneali, ma aumenta le aberrazioni corneali positive del sistema oculare determinando così un deterioramento della qualità ottica con il passare dell’età(14) (Fig. 3).
[caption id="attachment_1694" align="aligncenter" width="358"]
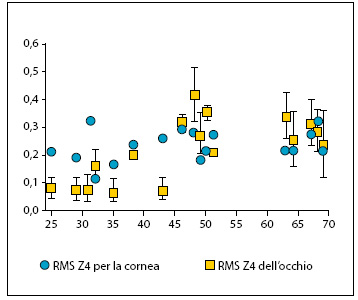
Fig. 3. Le aberrazione corneali (+) rimangono costanti nel tempo.[/caption]
Le IOL a morfologia sferica, ossia con entrambe le superfici del corpo ottico sferiche, introducono un’aberrazione sferica positiva che sommandosi a quella corneale può contribuire a ridurre la qualità visiva dopo un intervento di cataratta(15). I progressi tecnologici nella chirurgia della cataratta e nello sviluppo di IOL di nuovo design hanno condotto all’elaborazione di lenti asferiche sviluppate per compensare ed annullare l’aberrazione sferica positiva della cornea. Attualmente, sono presenti nel mercato diversi modelli di IOL con una differente misura di correzione dell’asfericità. Molti studi hanno dimostrato l’efficacia del design asferico delle IOL nel correggere le aberrazioni corneali sferiche positive (15,16) e di migliorare di conseguenza la sensibilità al contrasto(10,17,18,19). Le IOL asferiche migliorano la sensibilità al contrasto sia in condizioni mesopiche sia fotopiche (10,20,21). Molti studi hanno comparato la sensibilità al contrasto ottenuta con l’impianto di IOLs asferiche e le IOL sferiche (12,19,20) evidenziandone un miglioramento con le asferiche(17). Soltanto due studi non hanno evidenziato alcuna differenza fra IOL asferiche e IOL sferiche in termini di acuità visiva a basso e alto contrasto e sensibilità al contrasto(24,25). Queste differenze di risultati fra i vari studi potrebbero essere spiegate dai diversi tests, charts o strumenti utilizzati per misurare la sensibilità al contrasto(26). Il mercato attuale prevede già le IOL asferiche al 41,8% e nei prossimi anni al 54,9%(27).
IOLs asferiche e OCP La OCP rappresenta ancora oggi una delle maggiori complicanze postoperatorie in seguito a intervento di facoemulsificazione con impianto di IOL nel sacco, sebbene l’incidenza, che può dipendere da numerosi fattori fra cui la tecnica chirurgica, il design della IOL e il materiale dell’ottica della IOL, sia in forte riduzione (28,29). Il suo sviluppo è conseguente alla proliferazione e migrazione delle Cellule Epiteliali Lenticolari (Lecs) nello spazio tra la superficie posteriore della IOL e la capsula posteriore. Normalmente, la capsuloressi consente il sequestro e una corretta stabilizzazione della IOL all’interno del sacco, riducendo l’incidenza della opacizzazione capsulare. In tal modo, infatti, la IOL si pone a contatto con la superficie interna della capsula residua anteriore, e in specie con le cellule epiteliali lenticolari. Le conseguenze riportate sono rappresentate da riduzione dell’acuità visiva e fenomeni di aloni e abbagliamenti luminosi. Numerosi progressi sono stati fatti nel ridurre la OCP postoperatoria attraverso la modificazione del design della IOL. Infatti, Nishi et al. hanno dimostrato che un corpo ottico con un bordo squadrato causa una ridotta OCP rispetto a un corpo ottico con un bordo arrotondato(30), questo perché “l’effetto spigolo” si propone di porre una barriera fisica alla migrazione delle cellule. Per quanto riguarda, invece, l’asfericità della IOL, in uno studio del 2011, è stato dimostrato come l’incidenza di OCP non cambia significativamente tra le IOL sferiche e asferiche(31). Al contrario, il materiale della lente influisce sull’insorgenza dell’opacizzazione della capsula posteriore(32). In particolare l’uso di lenti in materiale acrilico sembra essere associato ad una minore incidenza di OCP, tanto che la maggior parte dei chirurghi (ASCRS = 69% e ESCRS = 75%) preferisce l’acrilico come miglior materiale dell’ottica(27).
Prof. Aldo Caporossi
Direttore UO Complessa di Oculistica
Dipartimento di Scienze Odontostomatologiche e Oftalmologiche dell’Università degli Studi di Siena
Dott. Gianluca Martone, Dott.ssa Patrizia Pichierri, Dott.ssa Patrizia Sergio
Dipartimento di Scienze Odontostomatologiche e Oftalmologiche dell’Università degli Studi di Siena
Bibliografia
1. Frezzotti R, Caporossi A, Mastrangelo D, Hadjistilianou T, Tosi P, Cintorino M, Minacci C. Pathogenesis of posterior capsular opacification. Part II: Histopathological and in vitro culture findings. J Cataract Refract Surg. 1990;16:353-60.
2. Samuelson SW, Koch DD, Kuglen CC. Determination of maximal incision length for true small-incision surgery. Ophthalmic Surg. 1991;22:204-7. 3. Uchio E, Ohno S, Kusakawa T. Spherical aberration and glare disability with intraocular lenses of different optical design. J Cataract Refract Surg 1995;21:690–696.
4. Applegate RA, Marsack JD, Ramos R, Sarver EJ. Interaction between aberrations to improve or reduce visual performance. J Cataract Refract Surg. 2003;29:1487–95.
5. Artal P, Ferro M, Miranda I, et al. Effects of aging in retinal image quality. J Opt Soc Am 1993; 10:1656–62.
6. Ginsburg AP. Contrast sensitivity and functional. Int Ophthalmol Clin 2003;43:5-16.
7. Aggarwal A, Khurana AK, Nada M. Contrast sensitivity function in pseudophakics and aphakics. Acta Ophthalmol Scand 1999;77:441–3.
8. Ricci F, Scuderi G, Missiroli F, et al. Low contrast visual acuity in pseudophakic patients implanted with an anterior surface modified prolate intraocular lens. Acta Ophthalmol Scan 2004;82:718-22.
9. Mierdel P, Kaemmer M, Mroche M et al. Ocular optical aberrometer for clinical use. J Biomed Opt 2001;6:200-4.
10. Charman WN, Chateau N. The prospects for super-acuity: limits to visual performance after correction of monochromatic ocular aberration. Ophthalmic Physiol Opt. 2003;23:479-93.
11. Wang L, Koch DD. Effect of decentration of wavefront-corrected intraocular lenses on the higher-order aberrations of the eye. Arch Ophthalmol 2005;123:1226-30.
12. Artal P, Berrio E, Guirao A, Piers P. Contribution of the cornea and internal surfaces to the change of ocular aberrations with age. J Opt Soc Am A Opt Image Sci Vis 2002;19:137-43.
13. Mester U, Dillinger P, Anterist N. Impact of a modified optic design on visual function: clinical comparative study. J Cataract Refract Surg 2003;29:652-60.
14. Chantra S, Pachimkul P, Naripthaphan P. Wavefront and ocular spherical aberration after implantation of different types of aspheric intraocular lenses based on corneal spherical aberration. J Med Assoc Thai. 2011;94 Suppl 2:S71-5.
15. Bellucci R, Scialdone A, Buratto L, et al. Visual acuity and contrast sensitivity comparison between Tecnis and AcrySof SA60AT intraocular lenses; a multicenter randomized study. J Cataract Refract Surg 2005;31:712–7.
16. Packer M, Fine IH, Hoffman RS. Wavefront technology in cataract surgery. Curr Opin Ophthalmol. 2004;15:56-60.
17. Caporossi A, Martone G, Casprini F, Rapisarda L. Prospective randomized study of clinical performance of 3 aspheric and 2 spherical intraocular lenses in 250 eyes. J Refract Surg 2007;23:639-48.
18. Casprini F, Balestrazzi A, Tosi GM, et al. Optical aberrations in pseudophakic eyes after 2.5-mm Nd:YAG laser capsulotomy for posterior capsule opacification. J Refract Surg 2008;24:702-6.
19. Morales EL, Rocha KM, Chalita MR, Nosé W, Avila MP. Comparison of optical aberrations and contrast sensitivity between aspheric and spherical intraocular lenses. J Refract Surg. 2011;27:723-8.
20. Packer M, Fine IH, Hoffman RS, Piers PA. Improved functional vision with a modified prolate intraocular lens. J Cataract Refract Surg 2004;30:986–992.
21. van Gaalen KW, Koopmans SA, Jansonius NM, Kooijman AC. Clinical comparison of the optical performance of aspheric and spherical intraocular lenses. J Cataract Refract Surg. 2010;36:34-43.
22. Kurz S, Krummenauer F, Thieme H, Dick HB. Contrast sensitivity after implantation of a spherical versus an aspherical intraocular lens in biaxial microincision cataract surgery. J Cataract Refract Surg 2007;33:393–400.
23. Munoz G, Albarran-Diego C, Montes-Mico R, et al. Spherical aberration and contrast sensitivity after cataract surgery with the Tecnis Z9000 intraocular lens. J Cataract Refract Surg 2006;32:1320-7.
24. Packer M, Ginsburg AP. Testing and reporting contrast sensitivity. J Cataract Refract Surg 2007;33:359-60.
25. Schaumberg DA, Dana MR, Christen WG, Glynn RJ. A systematic overview of the incidence of posterior capsule opacification. Ophthalmology 1998;105:1213–21.
26. Apple DJ, Solomon KD, Tetz MR, et al. Posterior capsule opacification. Surv Ophthalmol 1992;37:73-116.
27. Nishi O, Nishi K, Wickstrom K. Preventing lens epithelial cell migration using intraocular lenses with sharp rectangular edges. J Cataract Refract Surg 2000;26:1543–9.
28. Nanavaty MA, Spalton DJ, Gala KB, Dhital A, Boyce J. Effect of intraocular lens asphericity on posterior capsule opacification between two intraocular lenses with same acrylic material: a fellow-eye study. Acta Ophthalmol. 2011 Nov 8.
Dr. Carmelo Chines
Direttore responsabile